已知某溶液只存在OH-、H+ 、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下关系:
①c(Cl-)> c(NH4+) > c(H+) > c(OH-) ②c(NH4+) > c(OH-) > c(Cl-)>c(H+)
③c(NH4+) > c(Cl-)> c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+) > c(OH-)
填写下列空白:
⑴若溶液中只有一种溶质,则该溶质是_________________,上述四种离子浓度的大小顺序(填序号)______________。
⑵若四种离子的关系符合③,则溶质为______________;若四种离子的关系符合④,则溶质为______________
⑶将pH相同的溶液稀释相同的倍数,下面图像正确的是(填图像序号)______________。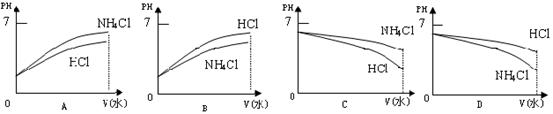
⑷若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O)(填“>”、“=”、“<”);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)_______c(OH-) (填“>”、“=”、“<”)。
实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:
⑴写出H2CO3的电离方程式为 ;
⑵Na2CO3溶液显碱性,原因是(用离子方程式表示)
;(2分)
⑶在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;(2分)
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;(2分)
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。(2分)
(1)用热水配制AlCl3溶液,会出现浑浊现象,原因是(用离子方程式和必要的文字说明):
。要消除浑浊现象,又不污染药品,可加入适量的__________溶液。
(2)常温下,有①0.01 mol/L HCl溶液;②pH=12的氨水,其中水的电离程度① ②,(选填“>”、“<”或“=”);若将①、②混合后所得溶液pH=7,则消耗溶液的体积:① ②(选填“>”、“<”或“=”)。若用①来滴定未知浓度的氨水,通常选用____________作指示剂,达滴定终点时各离子浓度由大到小的顺序是_________________________________。
(3)某温度(T℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则在该温度下,将100 mL 0.2 mol·L-1的稀盐酸与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
分别设计实验,用最佳方法证明明矾溶于水时发生的下列变化:
供选用的药品和仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液、pH试纸、氢氧化钠溶液、酒精灯、半透膜、电泳仪、聚光束仪
(1)证明明矾溶于水发生了水解反应_______________;
(2)证明明矾的水解反应是一个吸热反应_______________;
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H="+571.2" kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=—1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g)△H=—460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
土壤是人类从事农业、林业生产的一项重要资源。保护土壤防止污染、合理利用土壤是我们每个人的职责。请回答问题。
(1)有人说,电动自行车的发展,可能是环保背后的更大污染。这一说法的原因是
。
(2)农作物的生长对于土壤的酸碱性有一定的要求,有的喜酸性,有的喜碱性。适于一般农作物生长的PH在6.5-7.5之间,酸性或碱性过强都不利于作物的生长。土壤的碱性主要是由于土壤中的 、
、 等盐类的水解而产生,请用离子方程式表示
等盐类的水解而产生,请用离子方程式表示 、
、 的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
(3)土壤里发生着大量的氧化还原反应,许多氧化还原反应是在微生物存在的条件下进行的。如当土壤通气性良好时,土壤团粒的空隙里含有氧气,这时,在好气性微生物的作用下氧化反应得以顺利进行,土壤里的 等被氧化为
等被氧化为 等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
(本小题15分) A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
(1)写出四种元素元素符号:A、____B、____C、____D、____。
(2) F的电子式:_________________。
(3)写出E、F混合后加水的化学方程式:_________________________________。
(4)写出GJ的化学方程式:_________________________________。
(5)写出C单质与H水溶液反应的离子方程式:_____________________________。
A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
 |
1.写出B、D形成化合物电子式__________________。
2.写出下列有关物质化学式:E ___________, J _____________。
3.写出C单质与H水溶液反应的离子方程式___________________。
向纯碱溶液中滴入酚酞溶液,观察到的现象是______________ ,原因是________________________________________;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是_______________________________,原因是_______________________ ___________________。
化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色,轻轻摇动锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2与水反应的化学方程式 。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是 。
氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 。同时有红褐色沉淀生成,其原因是 。
试题篮
()