在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7 HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
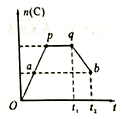
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);
(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7 ②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体 ④1mol/L的HF水溶液能使紫色石蕊试液变红
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断: (选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
I.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:
(1)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________。
(2)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的______H2(相同状况),则开始时反应速率的大小关系为__________,反应所需时间的长短关系是__________。
II.常温下,有浓度均为1 mol·L-1的下列四种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(均填序号)
(2)③中各离子浓度由大到小的顺序是______ __,升高温度,NH4Cl溶液的pH (填“升高”、“降低”或“不变”)
(3)向③中通入少量氨气,此时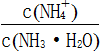 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
分析下列溶液蒸干后得到的固体是什么?写出化学式:
(1)Na2CO3溶液蒸干得到的固体物质是 ,
(2)(NH4)2SO4溶液蒸干得到的固体物质是 ,
(3)Ba(HCO3)2溶液蒸干得到的固体物质是 ,
(4)Na2SO3溶液蒸干得到的固体物质是 ,
(5)Mg(HCO3)2溶液蒸干得到的固体物质是 。
(6)Fe2(SO4)3溶液蒸干得到的固体物质是 。
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_________________________。
(3) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(4) 若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5) 取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的 pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 , c(OH-)-c(HA)=________mol·L-1
写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度
(2)c(Na+)+c(H+)==
(3)c(Na+)==
在t℃时,某NaOH稀溶液中,C(H+)=10-a mol/L,C(OH-)=10-b mol/L,已知a+b=12,
则:
(1)该温度下,水的离子积常数Kw= ;(具体数值)
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合(混合时溶液体积的变化忽略不计)后,溶液的pH= ,此时该溶液中由水电离的C(OH-)= mol/L;
(3)该温度下,CH3COOH和CH3COONa的混合溶液,若测得混合液的PH=6,则溶液中:C(CH3COO-)-C(Na+)= 。(具体数值)
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
回答下列问题:
(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 。
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA- , HA- H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
试题篮
()