(1)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(10分)X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
①X元素的原子半径是所有原子中最小的;
②Y元素的原子最外层电子数是最内层电子数的2倍。
③Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一。
④W与R能形成原子个数之比为2:1和l:1的离子化合物甲和乙。
根据要求回答问题:
(1)R在周期表中的位置是 。
(2)Y、R、W三种元素的原子半径由大到小顺序为 (用元素符号表示)。
(3)X2R与乙反应的化学方程式是 。
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示) 。0.1 mol·L-1该溶液中,各种阴离子的浓度由大到小关系为 。
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: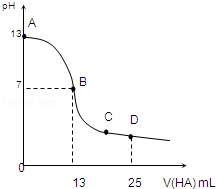
(1)写出MOH的电离方程式:____________________
(2)MOH与HA恰好完全反应时,混合溶液中由水电离出的c(H+)__________0.2mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系B点______________;C点___________;
(4)若D点测得混合溶液的pH=3,则 c(HA)+c(H+)=_____________
在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
下列微粒中:①Na+;② Fe3+ ;③ Cl-;④HCO3-;⑤ AlO2-
(1)既能电离又能水解的微粒是 (填序号)。
(2)②、③两种离子组成的盐的水溶液显 (填“酸性”或“碱性”或“中性”),用离子方程式表示原因 。
(3)④、⑤两种离子在水溶液中会发生反应而生成沉淀,写出相应的离子方程式 。
(1)请写出下列溶液的离子反应方程式:(13分)
①硫酸氢钠在溶液中的电离:
②氯化铵溶液除铁锈的原因:
③氯化铁溶液与偏铝酸钾溶液混合:
④碳酸钙的溶解平衡:
(2)在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,
以 (填“促进”、“抑制”)其水解。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产是 。把Na2SO3溶液蒸干,灼烧,最后得到的主要固体产是 。
已知:H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.0×10-11
(1)请写出H2CO3第一步电离的电离方程式__________,K2的表达式是K2= _____________
(2)计算常温时,0.1mol/L的Na2CO3溶液CO32-中的水解常数(忽略第二步水解)Kh=______________,溶液的pH= _______________。
(10分)(1)同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4,其中c(NH4+) 由小到大的顺序是 (填序号,下同)。
(2)同浓度的下列溶液:①(NH4)2SO4 ②NH4Cl ③Na2CO3 ④NaHCO3,其中pH 由大到小的顺序是 。
(3)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡固体⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是 ;
属于弱电解质的是 ;
属于非电解质,但溶于水后的水溶液能导电的是 。
写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度
(2)c(Na+)+c(H+)==
(3)c(Na+)==
在t℃时,某NaOH稀溶液中,C(H+)=10-a mol/L,C(OH-)=10-b mol/L,已知a+b=12,
则:
(1)该温度下,水的离子积常数Kw= ;(具体数值)
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合(混合时溶液体积的变化忽略不计)后,溶液的pH= ,此时该溶液中由水电离的C(OH-)= mol/L;
(3)该温度下,CH3COOH和CH3COONa的混合溶液,若测得混合液的PH=6,则溶液中:C(CH3COO-)-C(Na+)= 。(具体数值)
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
试题篮
()