常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
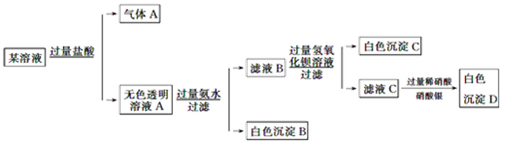
下列说法正确的是( )
| A.原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
| B.原溶液中是否存在Na+无法判断 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A.K+、 AlO2-、 Cl-、SO42- | B.H+、Ba2+、Cl-、NO3 |
| C.Ca2+、Fe2+、 NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
溶液中存在有五种离子,其中各离子个数比Cl-∶SO42-∶Fe3+∶K+∶M=2∶3∶1∶3∶1,则M为( )
| A.CO32- | B.Mg2+ | C.Na+ | D.Ba2+ |
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A.Cu2+、 H+、 Cl﹣ | B.K+、OH﹣、CO32﹣ |
| C.CO32﹣、OH﹣、Cl﹣ | D.K+、H+、Cl﹣ |
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:__________________________。
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是:
| A.溶液中共发生了1个氧化还原反应 |
| B.反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ |
| C.有胶状物质生成 |
| D.溶液颜色发生变化 |
常温下,下列各溶液中,可能大量共存的离子组是
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.c(H+)=1×10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
向含有Fe2+、Fe3+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是
| A.Fe2+ | B.NH4+ | C.Fe3+ | D.Mg2+ |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B.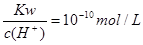 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:____________________。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+ 5种离子,现进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的离子是 ,一定不含的离子是__________,还有一种离子不能确定是否存在,要检验这种离子的实验方法是 。
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
试题篮
()