下列离子或分子能够在指定的分散系中大量共存的是
| A.与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- |
| B.0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- |
| C.铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- |
| D.空气中:SO2、NO、N2、NH3 |
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是
| A.a点对应的溶液中:Ca2+、Mg2+、Br-、NO3- |
| B.b点对应的溶液中:Al3+、Fe3+、MnO4-、NO3- |
| C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答: ___________, 不能确定是否存在的离子是________________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度_____________;
离子符号______,浓度_______________;
离子符号______,浓度________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是 ______________。
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是
| A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3 |
| B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3 |
| C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
| D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: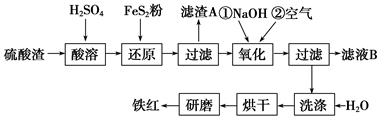
①酸溶过程中Fe2O3发生反应的离子方程式为_____________;“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式: FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4
下列表述正确的是
| A.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| C.将SO2通入Ca(ClO)2溶液中: Ca2++ 2ClO-+ SO2 + H2O=CaSO3↓ + 2 HClO |
| D.在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
| A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 |
| B.向0.1mo1/L该物质的溶液中清加0.L/molNaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如上图所示 |
| C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
| D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42--完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ |
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
下列说法正确的是
| A.沉淀甲可能是AgBr |
| B.沉淀丙一定是BaCO3 |
| C.气体甲的成份只有4种可能 |
| D.肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下
下列有关推断合理的是
| A.根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B.沉淀H为Al(OH)3、BaCO3的混合物 |
| C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)="0.05" mol·L-1 |
水溶液X中只可能溶有Na+、K+、Mg2+、Al3+、AlO2—、SiO32—、HCO3—、CO32—、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断正确的是
| A.K+、AlO2—和SiO32—一定存在于溶液X中 |
| B.HCO3—和SO42-一定不存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
| D.溶液中一定存在大量CO32— |
某雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验: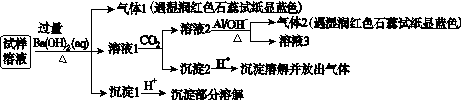
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
| A.试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B.试样中一定不含Al3+ |
| C.试样中可能存在Na+、Cl- |
| D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 |
SO42-、NO3-、Cl- |
| 阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题: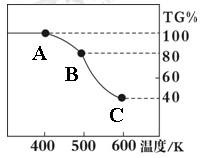
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO |
| B.b点对应的溶液中大量存在:NH、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO |
| D.d点对应的溶液中大量存在:Na+、K+、SO、Cl— |
实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理
Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中肯定含有的离子是① ;肯定不存在的离子是② ;还不能确定是否存在的离子是③ 。
Ⅱ、兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| I |
稀硫酸中加入铜片 |
无明显变化 |
| II |
硝酸钠溶液中加入铜片 |
无明显变化 |
| III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是 。
② 实验III中反应的本质是(用离子方程式表示) 。
试题篮
()