现有一定量的Cu和CuO混合物,向其中加入0.6 L 2.0 mol/L稀硝酸,混合物完全溶解,同时生成4.48 L NO(标准状况)。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0 g固体。(忽略溶液的体积变化)。下列说法正确的是
| A.该混合物中铜的质量为19.2 g |
| B.与该混合物反应消耗的HNO3的量为1.2 mol |
| C.加入NaOH溶液的体积是800 mL |
| D.Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是( )
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
现有三种制取硝酸铜的实验方案可供选用:下列有关说法正确的是
①铜与稀硝酸反应制取:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2 2CuO,CuO+2HNO3==Cu(NO3)2+H2O
2CuO,CuO+2HNO3==Cu(NO3)2+H2O
| A.制取等量硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入1 mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是( )
| A.12g | B.16g | C.24g | D.48g |
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是
| A.当生成沉淀达到最大值时,消耗NaOH溶液的体积一定为100mL |
| B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| C.当金属全部溶解时收集到NO气体的体积为2.24L |
| D.参加反应的金属的总质量一定是6.6g |
在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到 v mL时,恰好完全反应,得到沉淀质量为n 克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克 ②恰好溶解后溶液中的NO3-离子的物质的量为bv mol
③反应过程中转移的电子数为 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为 mol
mol
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.①②③⑤ |
将一定量硫酸、硝酸和KNO3溶液混合成100ml溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
| A.11.2 L | B.6.72 L | C.8.96 L | D.4.48 L |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )

| A.混合酸中NO3-物质的量为0.4mol |
| B.OA段产生的是NO,AB段的反应为: Fe+2Fe3+→3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为5 mol·L-1 |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法不正确的
A.a点的溶液呈酸性的原因为:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.c点沉淀的质量比a点沉淀的质量大 |
| C.b点加入Ba(OH)2溶液的体积为150 mL |
| D.至c点完成反应,反应的离子方程式可表示为: |
Al3++2SO42-+NH4++2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg∙cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
① ②
② ③
③ ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
| A.①②④ | B.②③④ | C.②④ | D.②③⑤ |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·mol-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60mL | B.45mL | C.30mL | D.75mL |
某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积):下列说法不正确的是( )
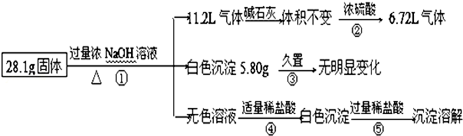
| A.混合物中一定不存在FeCl2和NaCl |
| B.反应④的离子方程式为:AlO2﹣+H++H2O=Al(OH)3↓ |
| C.混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 |
| D.白色沉淀5.80g是Mg(OH)2 |
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为 mol
mol
③反应过程中转移的电子数为 mol
mol
④生成标准状况下NO气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为( +
+ )mol
)mol
| A.2项 | B.3项 | C.4项 | D.5项 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.50 mL | C.30 mL | D.15 mL |
磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂。将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是
| A.Na3PO4 | B.Na4P2O7 |
| C.Na4P2O7和Na5P3O10 | D.Na3PO4、Na4P2O7和Na5P3O10 |
试题篮
()