N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物。
(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物。
①尿素中元素原子半径最大的原子结构示意图为 ;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因 ;
③已知:20oC时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3·H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂。
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式 ;
②制备NH2OH·HCl(盐酸羟胺)的一种工艺流程如下图所示:
ⅰ步骤中,发生反应的化学方程式为 ;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒。可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害。写出NO2ˉ在酸性条件下转化为氮气的电极反应式为 ________ 。
ⅲ步骤中,X为 (填化学式);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于 [已知KSP(BaSO3)= 5.0×10ˉ10;KSP(BaSO4)= 1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH。写出其阳极反应式 ;
向由Cu、Cu2O和CuO组成的混合物中,加入10 mL 6 mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu2O与稀硝酸反应的离子方程式 。
(2)产物中硝酸铜的物质的量为 。
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为 ,CuO的物质的量为 。
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g)  2NO(g) ΔH =" a" kJ·mol-1
2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g)  2NH3(g) ΔH =" b" kJ·mol-1
2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g)  2H2O(l) ΔH =" c" kJ·mol-1
2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
(Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)写出N的原子结构示意图: 。
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:_____________________。
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的化学方程式为 。
(2)化合物A可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱性条件下反应制得,其反应的离子方程式为 。
(3)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(4)请设计一个实验方案,研究温度对化合物A水溶液稳定性的影响 。
工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。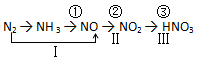
(1)写出N2的一种用途 。
(2)实验室制取物质NH3的化学方程式为 。
(3)写出工业制硝酸第③步反应化学方程式 。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:___________ 。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)48.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是( )
| A.1.5 mol | B.2.0 mol | C.2.5 mol | D.3.0 mol |
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+ ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+ =□Fe3++□N2O↑+□H2O
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
_ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式 .
(3)甲与氯化氢反应生成乙.乙所含化学键类型有 .在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是 。
②反应Ⅱ:2NH3(g)+ CO2(g)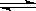 CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式 。
短周期元素N、Na、Al形成的物质在工农业生产、生活中应用广泛。
(1)Al在元素周期表中的位置为 ;其原子半径比Na (填“大”或“小”)。
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物。该化合物的晶体类型为 ;该化合物遇酸碱易被腐蚀,请写出它与NaOH溶液反应的离子方程式 。
(3)NH3的电子式为 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是 。
(4)标准状况下22.4L NH3与0.5L 1mol/L 氮元素的最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是 。
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质。请写出反应的化学方程式 。
及其盐都是重要的化工原料。
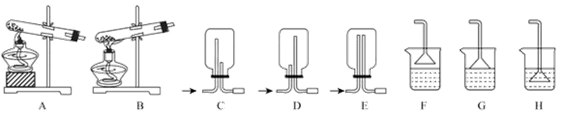
(1)用和
制备
,反应发生、气体收集和尾气处理装置依次为。
(2)按下图装置进行性质实验。
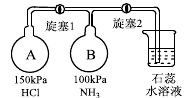
①先打开旋塞1,瓶中的现象是,原因是,稳定后,关闭旋塞1。
②再打开旋塞2,瓶中的现象是。
(3)设计实验,探究某一种因素对溶液中水解程度的影响。
限制试剂与仪器:固体、蒸馏水、100
容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、
计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中(溶液)表示所配制溶液的体积)。
| 物理量 实验序号 |
…… |
||||
| 1 |
100 |
||||
| 2 |
100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为,则
水解反应得平衡转化率为(只列出算式,忽略水自身电离的影响)。
(本题共12分)南美洲干旱地区有智利硝石,是制取炸药的重要原料,其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物。NaNO3溶于水时溶液的温度降低。
36.以下操作可从智利硝石分离出NaNO3:溶解、______________________________。
37.用NaNO3和浓硫酸反应可以制取硝酸,反应的化学方程式为____________________;
热的硝酸会腐蚀橡胶,制取装置中应该用____________________________________代替胶管和胶塞。
38.分离出的NaIO3可通过以下反应制得I2: 4NaIO3+10NaHSO3→7Na2SO4+3H2SO4+2I2+2H2O
简述从反应后得到的混合物中分离出I2:的操作___________________________________。
NaHSO3过多或过少,I2的产率都会降低,当NaIO3与NaHSO3的物质的量之比为1:2.6时,I2的产率为________________。
39.智利硝石资源有限(曾引起过南太平洋战争),现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有(请结合课本知识回答)____________、制硝酸、__________等;写出工业制硝酸的化学方程式________________________、_______________________。
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.050 |
n2 |
0.080 |
0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
(14分)近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为4:1时,写出发生反应的化学方程式: 。
(2)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①写出上述反应的离子方程式: 。
②若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为0.5 mol·L—1的次氯酸钠的体积为 mL。
(3)某工业废水中含有毒性较大的CN—,可用电解法将其转变为N2,装置如图所示。气体甲是 (写化学式),电解池中生成N2的电极反应式为 。
(14分)雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)ΔH= kJ·mol-1。
SO3(g)+NO(g)ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
a.体系密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)下图是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为 L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。
(10)按要求填空
(1)二氧化硫气体通入碘水,碘水褪色,该反应的化学方程式 。
(2)实验室制备氨气的化学方程式 。
(3)制备漂白粉的化学方程式 。
(4)收集满一烧瓶纯的二氧化氮气体做喷泉实验,假设溶液不扩散,所得溶液的物质的量浓度 。
(5)金属锌和硝酸物质的量之比为2:5恰好完全反应,该反应的化学方程式 。
(原创) (14分)通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。请按要求回答下列问题:
(1)图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
①Y元素在元素周期表中的位置为 。
②气态氢化物的稳定性:X_____(填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______(填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为 。
(2)图2是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是__________
| |
甲 |
乙 |
丙 |
丁 |
| A |
FeCl3 |
FeCl2 |
Fe2O3 |
Fe(OH)3 |
| B |
Cu |
CuO |
CuSO4 |
CuCl2 |
| C |
NO |
HNO3 |
NO2 |
NH3 |
| D |
Si |
Na2SiO3 |
SiO2 |
SiF4 |
(3)图3表示将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系,则ab段发生反应的离子方程式为_______________________________
试题篮
()