( 16分)下图表示几种无机物之间的转化关系.其中A 、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.
请回答下列问题:
(l)A的化学式是_____________,C 的电子式是_______________,Y 的名称是_______________.
(2)反应① 的化学方程式为______________________________________.
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)_______________ _____________________.
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是____________ ______.
(5)推测反应③ 的还原产物可能是______________________.
(6)19.2 g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
(本题12分)
磷是重要的非金属元素。磷单质及其化合物在工业生产中有着广泛的应用。
次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空
(1).磷原子的最外层电子排布的轨道表示式为 ______ ;氧原子核外电子云有 种不同的伸展方向,其最外层有 种不同运动状态的电子。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2).写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(3).磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是__________________________________________________。(请用文字描述)
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。
(4).写出该反应的化学方程式__________________________。
(5).每消耗24.0g碳时,有 mol电子发生转移。反应所得混合气体,折算成标况下,其气体密度为 g/L。
(14分)使用如图所示装置进行化学小实验,请填写下列空白: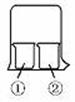
(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为 。
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为 ,反应的离子方程式为 。
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为 ,反应的化学方程式为 。
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因 ,写出浓硝酸和Na2SO3溶液反应的离子方程式 。
按要求回答下列问题:
(1)下列事实反映了硫酸、硝酸的什么性质:
①实验室用锌粒和稀硫酸反应制取氢气 ;
②浓硫酸能使胆矾晶体由蓝变白 ;
③浓硫酸使纸张变黑 ;
④硝酸溶解金属铜 ;
⑤可用稀硝酸与CaCO3作用制取CO2 。
(2)将6.4g铜与一定浓度的浓硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为1.12L,请回答下列问题:
①写出铜与浓硝酸反应生成NO2气体的离子方程式: ;
②参加反应的HNO3的物质的量是: mol。
非金属单质A经如下图所示的过程转化为含氧酸D,
已知D为强酸,请回答:
(1)若A常温下为 淡黄色固体,B是有刺激性气味的无色气体。
淡黄色固体,B是有刺激性气味的无色气体。
①画出A的原子结构示意图: 。
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为: 。
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为: 。
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式 。
②C→D的反应中氧化剂与还原剂物质的量之比为:
③写出A与H2反应产物的结构式:
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g)===2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g)===2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g)===2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对它们进行研究具有重要意义。请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度(mol/L) |
4×10−6 |
6×10−6 |
2×10−5 |
4×10−5 |
3×10−5 |
2×10−5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(3)消除氮氧化物和硫氧化物有多种方法。
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,当 =1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
=1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为 。
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,
理论上可再生 mol Ce4+。
Ⅲ.用活性炭还原法可以处理氮氧化物。如发生反应:
C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。
N2(g)+CO2(g) △H=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(答一种即可)。
下图为喷泉实验装置图。
(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质(如能用有关离子表示,请写出离子符号)的名称或离子符号。
| 实验编号 |
A溶液颜色 |
B溶液颜色 |
A溶液中溶质 |
| ① |
无色 |
红色 |
|
| ② |
黄色 |
红褐色浑浊 |
|
| ③ |
紫色 |
蓝色 |
|
| ④ |
无色 |
乳白色浑浊 |
|
(2)分析实验①中B溶液变红色的原因(结合方程式说明)______________ 。
实验②反应的离子方程式为________________________________________。
(18分)
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式为________。
(2)浓硝酸和浓盐酸反应的化学方程式为________。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为________。
Ⅱ.石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起。某研究小组将一定量的丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,乙在标准状况下的密度为1.5179g/L,过滤后向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g,已知气体乙可溶于水。请回答下列问题:
(1)甲的化学式为________。
(2)写出丙中非金属元素的离子结构示意图________。
(3)丙在盐酸中反应的化学方程式:________。(离子方程式表示)
(4)请设计合理的实验方案验证不同温度对丙与盐酸反应速率的影响
(5)为消除火灾隐患,下列措施可行的是________。
| A.石油入罐前脱硫 |
| B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 |
| D.罐体中充入氮气 |
汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
在氮单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 。原因是 。
(2)常用作制冷剂的物质是 ,原因是 。
(3)能与酸反应生成盐、在常温下为气态的物质是 写出它与HCl等强酸反应的离子方程式: 。
(4)在通常状况下是晶体、易溶于水、可以作氮肥、遇碱会放出带刺激性气味气体的物质是 ,写出它们与NaOH等强碱溶液反应的离子方程式: 。
(共18分)
(Ⅰ)无机盐A是医学上常用的镇静催眠药,由两种元素组成。将其溶于水,通入适量黄绿色气体B,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F。
(1)无机盐A中阳离子的结构示意图 。
(2)工业上制取漂白粉的化学反应方程式 。
(3)CO2和NH3两气体中,应该先通入溶液中的是 (填化学式),写出制备E和F的离子反应方程式
(Ⅱ)某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)﹤908 g·mol-1)的组成和性质,设计并完成了如下实验。
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:(1)浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应。
(2)常温下B呈液态且1个B分子含有10个电子
请回答如下问题:
(1)写出B分子的电子式 。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为 。
(3)X的化学式是 ,在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为 。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式 ,设计一个实验方案探究 红色固体的成分 。
肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式 ,肼的晶体类型 。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式 。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
写出该反应的热化学方程式 。
(4)室温下,N2H5Cl的水溶液显 (填酸、碱、中)性。
其原因是。
已知:H2O 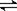 H + + OH- Kw = 1×10-14
H + + OH- Kw = 1×10-14
N2H4 + H2O 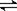 [N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + H2O 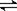 [N2H6]2++ OH- K2 = 8.4×10-15
[N2H6]2++ OH- K2 = 8.4×10-15
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为 。
与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是 。
(10分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种地壳中含量最多的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲的化学式是____________。
(2)甲与水反应的化学方程式是_______________________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之__________________________。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(16分)氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式: ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论: ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式: ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7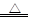 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。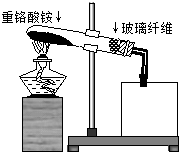
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是 ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂);
③写出该法验证NH3和O2存在的实验原理的化学方程式: 。
试题篮
()