某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________________。再由a向c中加2mL蒸馏水,c中的实验现象是_______________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________,理由是_____________________________________。
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是________________________;该小组同学实验目的是_________________,但此实验的不足之处是_____________________________。
工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
I.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为 。
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
| 试剂组合序号 |
固体试剂 |
NH3体积(mL) |
|
| a |
6.0 g Ca(OH)2(过量) |
5.4 g NH4Cl |
1344 |
| b |
5.4g (NH4)2SO4 |
1364 |
|
| c |
6.0 g NaOH(过量) |
5.4 g NH4Cl |
1568 |
| d |
5.4g (NH4)2SO4 |
1559 |
|
| e |
6.0 g CaO(过量) |
5.4 g NH4Cl |
1753 |
| f |
5.4 g (NH4)2SO4 |
1792 |
分析表中数据,你认为哪种方案制取氨气的效果最好 (填序号),从该方案选择的原料分析制气效果好的可能原因是 。
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。
(2)A中反应的离子方程式为 。
(3)D装置的作用有:使气体混合均匀、调节气流速度、 。
(4)D装置中的液体还可换成 (填序号)。
a.H2O b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是 。
(化学方程式每空4分,其余均2分,共22分)已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是__________,发生反应的化学方程式是 。
(2)B中加入的物质是__________,其作用是 。
(3)实验时在C中观察到的现象是
发生反应的化学方程式是
(4)实验时在D中观察到的现象是
D中收集到物质是__________,检验该物质的方法和现象是 。
某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程如下:将Ag和HNO3反应的生成气体通入足量水中,同时测定跑出气体体积,之后测定所得溶液中硝酸的物质的量。
(1)测定硝酸的物质的量
反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如下图所示。
在B容器中生成硝酸的物质的量为 mol,则Ag与浓硝酸反应过程中生成的NO2,在标准状况下的体积为 mL。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),请结合(1)中所得数据,判断Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。根据要求回答下列问题:
(1)用Ⅰ装置做实验时,实验过程中由于观察到烧瓶内有 现象,而不能有力证明反应产物是NO;收集NO能否用瓶口向上排空气法?答: (填“能”“否”)。
(2)用Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到 为止。
a.刚好浸没铜丝下端 b.刚好浸没铜丝中部 c. 单孔塞下沿与液面间不留有空隙
②关闭活塞,用酒精灯对U形管的A侧加热,当 时,撤去酒精灯。
(3)在(2)的实验中:
①什么情况下反应自动停止? 。
何处观察到无色的NO气体? 。
②如果再将分液漏斗的活塞慢慢打开,可在分液漏斗中观察到哪些明显现象?
答: 。
Ⅰ、 (1)某化学兴趣小组欲从下列装置中选取必要的装置制取 (NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 
(2)将装置C中两种液体分离开的操作名称是__ _______。
装置D的作用是 。
Ⅱ、为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_________ ____
装置B中碱石灰的作用是_____ __
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_______________ ______
(3) 装置C的试管中反应的离子方程式为 ______________
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 |
实验现象 |
| I.检验装置的气密性 |
|
| II.…… |
|
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 |
①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(1)①中发生反应的离子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ 。
(4)II的操作是 ,目的是 。
(5)该同学得出结论所依据的实验现象是 。
亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如右图所示(部分夹持装置略)。已知: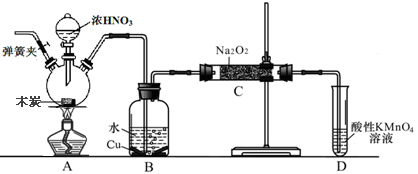
①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭__________g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。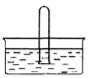
①NO2溶于水的化学方程式是_________________________。
②使试管中NO2完全被水吸收的操作是______________________________。
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为
a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。
连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是 。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作: 。装置E中观察到的主要实验现象有 。
(3)装置C的作用是 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: (写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: 。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为____________;Ⅳ中发生反应的化学方程式为____________________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ 中现象为_____,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为__________。
氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有
关性质。
(1)装置A中烧瓶内试剂可选用__________(填序号)。B的作用是_______。
a.碱石灰 b.浓硫酸 C.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_______(填I或Ⅱ)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为__________________________________________________。 该反应证明氨气具有_________ 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_________(填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成0.5 L溶液,所得溶液的物质的量浓度为________________mol/L。
亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
【查阅资料】
①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
【实验操作】
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 。
(3)检验C中产物有亚硝酸钠的实验方案(简述实验步骤、现象及结论)及相关的离子反应方程式为 。
(4)经检验C产物中亚硝酸钠含量较少。
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。
生成碳酸钠的化学方程式是 。为排除干扰,甲在B、C装置间增加一个U形管,U形管中盛放的试剂应是 (写名称)。
b.乙同学认为上述装置改进后,还会有空气参与反应导致产品不纯,所以在实验操作①之前应增加一步操作,该操作是 。
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3===N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子______________________________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是________________________________________________________________。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。

(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h;用A装置制取NH3的化学反应方程式为 .
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________ (选填字母编号);

| A.碱石灰 |
| B.生石灰 |
| C.无水氯化钙 |
| D.无水硫酸铜 |
E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 。
试题篮
()