氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是 。
(2)实验室常用如下图所示装置制取并收集氨气。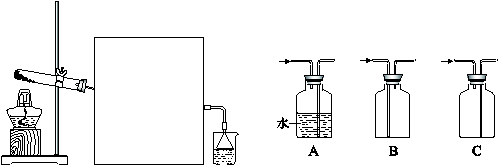
①实验室制取氨气反应的化学方程式是 。
②图中方框内收集氨气的装置可选用 (填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是 。
(3)工业上用NH3制取NO反应的化学方程式是 。
亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2 21℃、NO -152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
如下图所示,是实验室制备某常见气体的实验装置,请填空:
(1) 该实验装置制备的常见气体是(填写化学式): 。
(2) 制备该气体的化学方程式是: 。
(3) 收集该气体的方法是: 。
(4) 检验该气体是否收集满的方法是:
。
(5) 将充满该气体的试管倒立于水槽中,可以看到的现象是:
。
氨气具有还原性。在一定条件下,氨气可与氧化铜反应,反应后得到三种物质,其中有两种单质,下图为氨气与氧化铜反应并验证部分产物的装置(夹持装置略):
请回答下列问题:
(1)实验室制取氨气的化学方程式是 。
(2)能证明氨气具有还原性的现象是 ;
B装置的作用是 。
(3)A中反应的化学方程式是 。
用下图所示实验装置进行相应实验,能达到实验目的的是
| A.制氨气时,用装置①吸收尾气 |
| B.按装置②所示的气流方向收集NH3等 |
| C.用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D.用图④所示装置分离CCl4萃取碘水后的混合液 |
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)甲、乙、丙三个装置中共同发生的化学方程式是 。
(2)和甲装置相比,乙装置的优点是可以控制反应的开始与停止,还可以 。
(3)为了进一步验证NO2和水的反应,当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的 水进人②试管,应如何操作?
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
(届陕西省延安市秋高考模拟理综化学试卷)
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______
II.实验装置如图所示:
(1)写出浓硝酸受热分解的化学方程式:__________________________________。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持 木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是 。
III.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。_________________________________________________。
根据下图装置进行实验,已知:Na2O2与H2O和CO2都能反应并生成O2,但与NH3不反应
回答下列问题:。
(1)在受热的试管A中NH4HCO3发生反应的化学方程式为: 。
(2)被加热的铂丝处发生的化学方程式为:___________________________________。
(3)B中出现的现象为:___________________________________________________。
(4)烧杯C中发生的现象为________________________________________________。
(5)倒置漏斗的作用 。
(届北京市海淀区高三第二学期适应性练习理综化学试卷)
某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 |
浓硝酸与水的体积比 |
实验现象 |
| Ⅰ |
1:1 |
反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ |
1:3 |
反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ |
1:5 |
反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
铜与稀硝酸反应的离子方程式为 ;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为 g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是 。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到 ,说明装置的气密性良好。
②步骤Ⅲ操作的目的是 。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是 ,能确定NO完全被溶液吸收的现象是 。
(届河北省唐山市高三第一次模拟考试理综化学试卷)
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。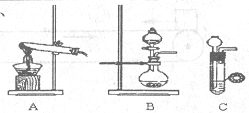
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| |
实验装置 |
实验药品 |
制备原理 |
| 甲小组 |
A |
氢氧化钙、氯化铵 |
反应的化学方程式为 ① |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____ ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
Ⅰ、氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1)下图烧瓶中盛有Na2O2固体,分液漏斗中盛有浓氨水,利用图示仪器装置(加热及夹持固定装置均已略去)进行氨的催化氧化实验。请根据下列要求回答问题:
①请选择实验装置,按气流方向从左到右连接顺序是(填字母)( )→( )→( )→E;
②硬质玻璃管B中的反应方程式为 ;
Ⅱ、①分别将氯气和二氧化硫通入品红溶液中,可观察到红色都褪去,该过程中分别体现了氯气的 性、二氧化硫的 性。
②一定条件下,向碘水中通入足量氯气,完全反应后再滴加淀粉溶液无明显现象。若原有10.0mL1.0mo1·L-1的碘水,反应中共转移了0.1mo1电子,则该反应的离子方程式为: 。
Ⅲ、为了探究NO做催化剂参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生反应化学方程式为 、
,再喷射适量蒸馏水即得硫酸型酸雨 。
浓硝酸、稀硝酸都具有强氧化性,某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器的装置已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应
2NO2 + 2NaOH === NaNO3 + NaNO2 + H2O
(1)浓硝酸与NO反应的氧化产物与还原产物的物质的量之比为
(2)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(3)滴加浓硝酸之前的操作依次是检验装置的气密性,加入药品,打开弹簧夹后
(4)装置①中发生反应的化学方程式是
装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论所依据的实验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究。回答下列问题:
(1)图中E装置名称是_____________。
(2) N、C、Si的非金属性由强到弱的顺序是:_____________;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为_______;试剂C为_________(填序号)。
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
(3) 乙同学设计的实验中(酒精灯加热装置在图中未画出),若试剂C为溴化钾溶液溶液外,还需要用到的试剂有:试剂A为________;试剂B为 ________。
试题篮
()