为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。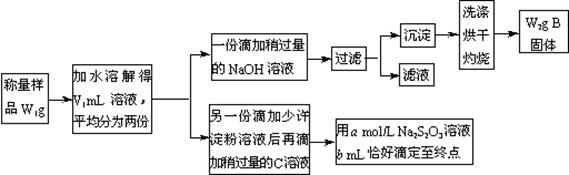
请回答下列问题:
①写出B和C的化学式:B ,C 。
②滴定时,判断滴定达到终点的现象是 。
③KIO3的质量分数是 (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(5分)为了预防碘缺乏病,国家规定每千克食盐中应含有18~50毫克的碘元素。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品500克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.01mol/L的硫代硫酸钠(Na2S2O3)溶液滴定,用去10.00mL时蓝色刚好褪去。用双线桥法标注①的电子转移情况并通过计算说明该加碘食盐是否为合格产品。
(有关反应:①IO3-+5I-+6 H+==3I2+3H2O ②I2+2Na2S2O3="=2" NaI+Na2S4O6)
空气中的自由电子附着在气体分子或原子上形成的空气负离子(也叫阴离子)被人们称为“空气维生素”。下列各微粒中肯定不属于空气负离子的是( )
| A.O2- | B.O2-.(H2O)n |
| C.CO4-.(H2O)2 | D.PO43- |
(本题8分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来 ,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。
,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。
试回答下列问题:
(1)实验1中,沉淀最终变为: 色,写出沉淀变色 的化学方程式 。
的化学方程式 。
(2)实验2中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动, 针筒内有白烟产生外,气体的颜色变化为 ,最后两个针筒中共剩余气体的体积约为 mL。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1)将菱锌矿研磨 成粉的目的是____。
成粉的目的是____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之 后的操作依次为______、______、过滤,洗涤,干燥。
后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B
→B→D时,两次使用B装置,其中所盛的药品依次是 、
(写化学式);D装置的作用是
。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有 、
。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a ;b ;c 。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→ → → (填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是 (用字母表示);用化学方程式解释红棕色气体产生的原因: 、
。
太平洋岛国瑙鲁盛产一种高品位的磷矿石——鸟粪石,其化学式为MgNH4PO4,下列关于该物质的叙述中不正确的是
| A.鸟粪石既属于镁盐又属于磷酸盐 |
| B.鸟粪石既能与强酸反应,又能与强碱反应 |
| C.鸟粪石中既含有离子键又含有共价键 |
D.鸟粪石中两种阳离子的电子式分别为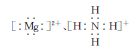 |
(14分)有关含铬化众物的相互转化关系如下:
回答下列问题:
(1 )上述反位中属于氧化还原反位的是_________ (填编号),
(2) 工业上处理含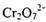 的废水时,一般将剧毒的
的废水时,一般将剧毒的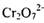 转化为
转化为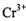 ,以碳为阴极,铁作阳极,电解处理含
,以碳为阴极,铁作阳极,电解处理含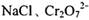 的酸性废水。写出电极反应和溶液中进ff的反应的离子方程式:_______________
的酸性废水。写出电极反应和溶液中进ff的反应的离子方程式:_______________
阳极:____________________;
阴极:____________________
(3) 上图中有一种微粒M有两性,该微粒是_______________分别写出该微粒与强酸和强碱反应的离子方程式:______________________________
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
| A.A12O3、SO2、CO2、SO3 | B.C12、A12O3、N2O5、SO3 |
| C.CO2、C12、CaO、SO3 | D.SiO2、N2O5、CO、C12 |
下列各组物质中,满足右图物质一步转化关系的选项是
| 选项 |
X |
Y |
Z |
| A |
Na |
NaOH |
NaHCO3 |
| B |
Cu |
CuSO4 |
Cu(OH)2 |
| C |
C |
CO |
CO2 |
| D |
Si |
SiO2 |
H2SiO3 |
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如图所示:
(1)当加入B溶液110 mL时,溶液中的沉淀是 (填化学式)
(2)将A.B溶液中各溶质的物质的量浓度填入下表:
| 溶 质 |
Na2SO4 |
BaCl2 |
AlCl3 |
FeCl3 |
| /mol·L-1 |
|
|
|
|
(3)写出滴加B溶液90-100mL时的离子方程式:
。
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)
| A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 |
| B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 |
| C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 |
| D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |

向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是( )
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1mole-时生成2mol白色沉淀 |
| C.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| D.通入SO2时,SO2与I2反应,I2作还原剂 |
下列各组物质按右图所示转化关系每一步都能一步实现的是( )
 |
甲 |
乙 |
丙 |
丁 |
] |
| A |
FeCl3 |
FeCl2 |
Fe2O3 |
Fe(OH)3 |
|
| B |
Cu |
CuO |
CuSO4 |
CuCl2 |
|
| C |
NO |
HNO3 |
NO2 |
NH3 |
|
| D |
Si |
Na2SiO3 |
SiO2 |
SiF4 |
将已去除表面氧化物的铁钉(碳素钢)放入冷浓 硫酸中加热,充分应后得到溶液X并收集到气体Y。
硫酸中加热,充分应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 ,应选用 (填序号)。
,应选用 (填序号)。
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 | C.浓氨水 | D.酸性 溶液 溶液 |
丙同学认为气体Y中除 外还可能含量有
外还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
(2)装置B中试剂的作用是 。
(3)认为 气体Y中还含有Q的理由是 (用化学方程式表示)。
气体Y中还含有Q的理由是 (用化学方程式表示)。
(4)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(5)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
试题篮
()