(8分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。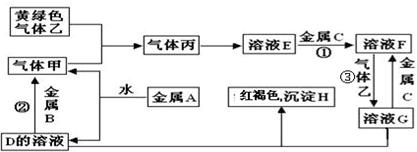
(1)写出下列物质的化学式:F中的溶质 _________; 丙____________。
反应③的离子方程式
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________
A与水反应的离子方程式
(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 |
需加入的试剂 |
有关离子方程式 |
| FeSO4 (Fe2(SO4) 3) |
|
|
| Mg(Al) |
|
|
| CO2 (HCl) |
|
|
| SiO2(CaCO3) |
|
|
(7分)A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式 。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是
(11分) 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D为单质,E为氯气,试回答:
(1)写出下列物质的化学式:A是________,D是________,K是________。
(2)写出反应“C→F”的离子方程式:_____________________________________________。
(3)写出反应“F→G”的化学方程式:_____________________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象及化学方程式:
_________________________________,___________________________________。
国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
①若金属钠等活泼金属着火时,应该用 来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是 。
③使用漂白粉Ca(ClO)2漂白衣物原理的化学方程式是 。
④在自然界中,能实现氮的固定的化学方程式是 。
⑤胃舒平(含有氢氧化铝)治疗胃酸(盐酸)过多的离子反应方程式: 。
⑥过氧化钠在太空及潜水艇中作为供氧剂的两个化学方程式是 、 。
⑦明矾(KAl(SO4)2·12H2O)是具有净水作用的复盐,请你写出其在水中的电离方程式 。
下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。
(1)第3周期中金属性最强的元素是 (填元素名称);
(2)S原子结构示意图为 ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C、N和O原子半径由小到大的顺序的是 ;
(5)第3周期中气态氢化物最稳定的是 ;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是 ,常用于制造 (填一种高性能的现代通讯材料的名称);
(7)铝是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(8)N元素形成的一种氢化物的化学式是 ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的反应为: 。
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
已知有以下物质相互转化:
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式) ;
(2)写出B的化学式 ,F的化学式 ;
(3)写出由G转变成H的化学方程式 ;
(4)写出检验I溶液中阳离子的离子方程式 ;
向I溶液中加入A的有关离子反应方程式是 。
(14分)A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
(1)D的离子结构示意图为_____________。
(2)B、C、D形成的简单离子半径由大到小的顺序: > > (写离子符号)
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到60 mL 10.0 mol/L乙的浓溶液中,充分反应,共收集到4.48L(标准状况)气体,则该气体的成分是_________,反应中电子转移数为____________。若使上述中反应后剩余的铜片继续溶解,可向其中加入稀硫酸,写出反应的离子方程式: 。
(4)将两份足量的B单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________。
(1)现有下列四种物质:①AlCl3 ②NH3 ③NaHCO3 ④SiO2。
为石英主要成分的是 (填序号,下同),能进行喷泉实验,极易溶于水的气体是 ,向其溶液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是 ,俗称为“小苏打”的是 。
(2)483克Na2SO4·10H2O所含的Na+的物质的量是 ,SO42-的物质的量是 。
如图是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,
请回答下列问题:
(1)焰火利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体,且发现只有氯元素的化合价发生变化。请写出该反应的方程式 。
(3)如图所示的五元环代表A、B、C、D、E五种化合物,
圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①D的化学式是_________.
②A、B、E中均含有的一种元素名称为______________。
③B的电子式是______________。
④C与纯碱反应的化学方程式为 。
如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。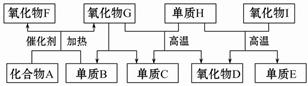
(1)化合物A的化学式是_______________________。
(2)组成单质E的元素在元素周期表中的位置是____________________________;
H+I反应的化学方程式为______________________________________。
(3)标准状况下,将2.24 L氧化物F和1.68 L单质B同时通入1 L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=___________。此时再向溶液中通入2.24 L化合物A,完全反应后所得溶液的pH<7,用离子方程式表示其原因:____________________________________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为________________________________________________。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①、②均为工业上的重要反应。
请回答下列问题:
(1)G是 ,K是 (填化学式)。
(2)C的原子结构示意图为 。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
按要求书写下列反应方程式:
(1)用氢氟酸可以刻蚀玻璃,请写出其反应的化学方程式:
。
(2)氢氧化亚铁在空气中久置被氧化,请写出其反应的化学方程式:
。
(3)氢氧化铝沉淀可溶于过量氢氧化钠溶液,请写出其反应的离子方程式:
。
(4)向硅酸钠溶液中通入过量的CO2气体,请写出其反应的离子方程式:
。
(5)将铜片放入在FeCl3溶液中,请写出其反应的离子方程式:
。
(14分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
用玻璃棒蘸取浓硝酸滴在PH试纸上,试纸逐渐变白,这种漂白现象说明浓硝酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
①Cu + HNO3(浓)→ Cu(NO3)2
②Cu + HNO3(稀)→ Cu(NO3)2
③Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
(3)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,若使剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)若将12.8g铜跟一定质量的浓HNO3反应,铜消耗完时,共产生气体5.6L(标准状况) (不考虑N2O4),则所耗HNO3的物质的量 mol.
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
试题篮
()