运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。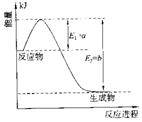
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: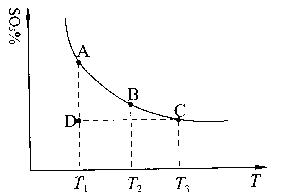
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,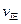
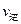 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时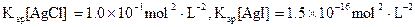 )
)
氢化锂(LiH)、氘化锂(LiD)、氚化锂、(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是 ( )
A.LiH、LiD、LiT是同一种物质
B.LiH、LiD、LiT中氢元素的合化价均为+1价
C.H、D、T之间互称为同位素
D. LiH、LiD、LiT在反应中常做氧化剂
下列反应中,相关示意图像错误的是 ( )
| A |
B |
C |
D |
||||||||
| 将二氧化硫通入到一定量氯水中 |
将氨水滴入到一定量氯化铝溶液中 |
将铜粉加入到一定量浓硝酸中 |
将铁粉加入到一定量氯化铁溶液中 |
||||||||
|
|
|
|
下列叙述中正确的是 ( )
| A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
| B.向Fel2溶液中通入少量Cl2,再滴加少量CCl4,振汤、静置,下层液体为紫色 |
| C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收 |
D.将SO2气体通入溴水,欲检验是否有SO 生成,可向溶液中滴加Ba(NO3)2溶液 生成,可向溶液中滴加Ba(NO3)2溶液 |
下列关于分类的说法正确的是
| A.置换反应都属于离子反应 |
| B.煤的干馏、煤的液化都属于物理变化 |
| C.Fe(OH)3胶体和CuSO4溶液都是混合物 |
| D.冰醋酸、纯碱、小苏打分别属于酸、碱、盐 |
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素。A是所有元素中原子半径最小的,C元素原子最外层电子数是D元素原子最外层电子数的一半,D元素最外层电子数是K层电子数的3倍,B元素原子的最外层电子数比D的少2个。E是与D同主族的短周期元素且原子半径小于D。请回答下列问题:
(1)五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M是 (写化学式,写一个即可,下同),能抑制水电离的物质N是 。25℃时,pH=a的M溶液中水电离出的H+浓度与pH=a的N溶液中水电离出的H+浓度之比为 。
(2)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式:
。
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 。
某些化学反应可以表示为: A + B → C + D + H2O 请回答下列问题:
(1)若A为红色的金属单质,B为第二周期某种元素的最高价氧化物的水化物,D在常温下可以转化为具有相同化合价的另一种氧化物E,则D和E分别为 ;
(2)若D分子的空间构型为三角锥形,C在实验室中常用作干燥剂,则A的晶体类型为 、电子式为 ;
(3)若C、D均为气体且都能使澄清石灰水变浑浊,写出该反应的化学方程式 ;
(4)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: ;
在某稀溶液中含有0.2mol HNO3和x mol H2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标准状况下的体积为4.48L,则x值至少为
| A.0.6 | B.0.4 | C.0.3 | D.0.2 |
下列各组物质中,不能满足“ ”转化关系的一组是
”转化关系的一组是
| |
X |
Y |
Z |
| A |
Si |
SiO2 |
Na2SiO3 |
| B |
CH2=CH2 |
CH3CH2Br |
CH3CH2OH |
| C |
Al2O3 |
NaAlO2 |
Al(OH)3 |
| D |
Cu |
CuO |
CuSO4 |
将6.4gCu加入到60mL2.0mol/L的硫酸溶液中,无明显现象,再加入(或通入)足量的下列物质,铜能够完全溶解的是
| A.NaNO3 | B.O2 | C.H2SO4 | D.FeCl2 |
我国南方饮用水大多为河水。由于河水中含有较多的泥沙、悬浮物、细菌等。在将河水用做饮用水之前需经下面A、B、C三步处理:
(1)A步中加入明矾的作用是____________________________________________。
(2)能够消毒杀菌的步骤是______________________________________________。
(3)可以除去较大颗粒、悬浮物的步骤是__________________________________。
(4)经过上述步骤,所得到的饮用水是___________(填“纯净物”或“混合物”),其原因是__________________________________________________________________。
物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。C是一种气体,D是白色胶状沉淀,E是白色固体。A、B、C、D、E间的转化关系如右图所示:
(1)写出A、B、C、D、E的化学式:
A____________、B____________、C____________、D____________、E____________。
(2)写出下列变化中的有关反应方程式:
①B+C D:_________________________________。
D:_________________________________。
②E A:_________________________________。
A:_________________________________。
已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且都不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请完成下列问题:
(1)写出元素X、Y、Z的元素符号:X___________,Y___________,Z___________。
(2)写出A、B、C、D的化学式:A___________,B___________,C___________,D___________。
(3)写出③中反应的化学方程式:
__________________________________________________。
(4)写出④中反应的化学方程式:
___________________________________________________。
试题篮
()