下列有关热化学方程式书写及对应表述均正确的是
| A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol |
| B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol |
| D.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/L |
有关能量的判断或表示方法正确的是
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
下列说法中,正确的是
| A.CO燃烧是放热反应 |
| B.升高温度,可以改变化学反应的反应热 |
| C.1 mol CH3COOH与1 mol NaOH完全中和,所放出的热量为中和热 |
| D.1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
有关能量的判断或表示方法正确的是 ( )
| A.由:H+(aq) + OH-(aq)= H2O(l)△H =-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.从C(石墨)= C(金刚石)△H =" +" 1.9kJ/mol,可知石墨比金刚石更稳定 |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)="2" H2O(l)△H =-285.8kJ/mol |
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ∙mol-1 2NH3(g)△H=-38.6kJ∙mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
下列说法正确的是
| A.CO能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| B.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
已知热化学方程式(Q1、Q2均为正值):
C(s)+ O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量 |
| D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量 |
下列说法正确的是
A.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ/mol 的ΔH为-384 kJ/mol |
| B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为: C8H18(g)+12.5O2(g)= 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
C.2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol 下图可表示该反应过程与能量的关系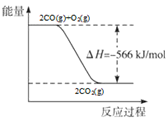 |
| D.S(s)+O2(g)=SO2(g);ΔH1 S(g)+O2(g)=SO2(g);ΔH 2则ΔH1>ΔH2 |
Zn还原SiCl4的反应如下:
SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH1
Si(s) + 2ZnCl2(g) ΔH1
SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH2
Si(s) + 2ZnCl2(g) ΔH2
下列说法正确的是
| A.Zn(l)=Zn(g) ΔH =1/2(ΔH1-ΔH2) |
| B.用硅制作的太阳能电池是将化学能转化为电能 |
| C.增加Zn(g)的量,ΔH2变大 |
| D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。 |
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
为保护环境并缓解能源危机,专家提出利用太阳能促使燃烧循环使用的构想,转化关系如图所示。
已知:
(1)过程Ⅰ可用如下反应表示:①2CO2 2CO+O2
2CO+O2
②2H2O(g) 2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+4H2O ________+3O2。
________+3O2。
(2)25 ℃时,a g CH4完全燃烧释放出b kJ热量。下列说法不正确的是( )。
| A.过程Ⅰ是将太阳能转化成化学能 |
| B.反应⑤的另一种产物为CH4 |
| C.ΔH1=-ΔH2 |
| D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1 |
下列说法正确的是:
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g) H2O(l) 的ΔH = +40.69 kJ·mol-1 H2O(l) 的ΔH = +40.69 kJ·mol-1 |
| B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ |
C.H2(g)+Br2(g)=2HBr(g)△H=-72kJ·mol-1其它相关数据如下表: 则表中a为230 |
| D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
下列说法中正确的是
| A.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照条件下和点燃条件下的ΔH不同 |
| B.常温下,2A(s)+B(g)= 2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 |
| C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热 |
| D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
试题篮
()