在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
下列有关热化学方程式的叙述正确的是
| A.已知2H2 (g)+O2(g) |
| B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq) + HCl(aq) |
| C.已知C(石墨,s) |
| D.已知C (s) + O2(g) |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
| A.Q1< Q2 |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
已知:N2(g)+3H2(g) 2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| |
H2(g) |
N2(g) |
NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ |
436 |
946 |
a |
A.如图可表示合成氨过程中的能量变化
B.a的数值为391
C.Q1的数值为92
D.相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H="-221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H="-" a kJ/mol, |
Ⅱ:
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
已知反应 ①
②稀溶液中,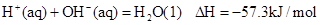 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
| A.等质量的O2比O3能量低,由O2变为O3为放热反应 |
| B.O3比O2稳定,由O2变为O3为吸热反应 |
| C.O2比O3稳定,由O2变为O3为放热反应 |
| D.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
下列说法正确的是( )
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
已知25℃、10lkPa条件下:
由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
下列说法或表示方法正确的是
| A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol |
C.已知:2SO2 (g) + O2 (g) 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 |
| D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0 |
试题篮
()