下列物质中既有离子键又有共价键的可溶性化合物是
| A.H2SO4 | B.BaSO4 | C.N2 | D.NaOH |
下列说法正确的是
| A.H2O和H2O2中的化学键类型完全相同 |
| B.N2的结构式为N—N |
| C.一个D216O分子所含的中子数为10 |
D.NaCl的电子式为 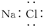 |
下列化合物中,既存在离子键又存在共价键的是
| A.碳酸钠 | B.乙醇 | C.氯化钾 | D.一氧化碳 |
下列化学用语正确的是
A.CH4分子的球棍模型: |
| B.乙烯的结构简式:CH2CH2 |
| C.氯化钠的分子式:NaCl |
D.K+的结构示意图: |
下列说法中,正确的是
| A.HCl气体溶于水形成盐酸,存在H+,所以HCl为离子化合物 |
| B.含金属元素的离子一定是阳离子 |
| C.含有共价键的化合物一定是共价化合物 |
| D.稀有气体原子之间不易形成共价键 |
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
下列说法正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
下列分子内部都存在着极性键的一组物质是
| A.H2S、NH3、SO3 | B.CO2、NH4Cl、Na2O2 |
| C.N2、CS2、NO | D.CaO、H2O2、CH4 |
X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是
| A.Z可以电离 | B.Z可以表示为XY2 |
| C.X形成+2价阳离子 | D.Z的电子式为  |
下列叙述错误的是
| A.随着原子序数增多,碱金属的原子半径逐渐增大 |
| B.卤素单质的熔沸点随着原子序数的增大而降低 |
| C.离子化合物中肯定含离子键 |
| D.原电池的负极发生氧化反应 |
试题篮
()