(12分)下列物质:①H2②HF ③H2O2 ④KF ⑤NH4Cl ⑥C2H2⑦N2H4+⑧BF3⑨H2O ⑩N2(填序号)
(1)只含非极性键的是___________________
(2)只含极性键的极性分子是_____________
(3)既有极性键又有非极性键的是_________
(4)只有σ键的是_______________________
(5)既有σ键又有π键的是_______________
(6)含有配位键的是_____________________
下列说法正确的是
| A.分子晶体中一定存在分子间作用力 |
| B.分子中含有两个氢原子的酸一定是二元酸 |
| C.含有金属阳离子的晶体一定是离子晶体 |
| D.元素的金属性越强,失去的电子数就越多 |
人们在研究金星大气成分时发现金星大气中有一种称为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列有关COS的推测不正确的是
| A.COS分子是含有极性键的极性分子 |
B.COS的电子式为: |
| C.COS的分子中所有原子满足8电子稳定结构 |
| D.COS分子中三个原子处于同一直线上 |
下列有关氮气的叙述不正确的是
| A.氮分子为非极性分子 |
| B.在灯泡中充入氮气可防止钨丝被氧化 |
| C.氮元素比磷元素非金属性强,所以硝酸比磷酸酸性强 |
| D.氮分子中有2个σ键1个π键 |
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。
有以下物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。请用上述物质的数字序号填空:
(1)只存在离子键的是
(2)既存在离子键又存在极性键的是
(3)不存在化学键的是
(4)属于共价化合物的是
(共4分)(1)写出下列物质的电子式: HClO 。
(2)用电子式表示下列物质的形成过程:CaCl2 。
下列物质中不含非极性共价键的是
①Na2O2 ②CCl4 ③O2 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2
| A.①②③④ | B.④⑤⑥ | C.②③⑤ | D.②④⑥ |
下列化学用语书写正确的是
A.氯原子的结构示意图: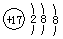 |
| B.作为相对原子质量测定标准的碳核素:614C |
C.氯化镁的电子式: |
D.用电子式表示氯化氢分子的形成过程: |
根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性。以下各组粒子结构不相似的是
| A.CO和N2 | B.O3和NO2— | C.CO2和N2O | D.N2H4和C2H4 |
试题篮
()