(1)X的基态原子核外有3个原子轨道充满电子,其价电子排布式为________
(2)M+中3d能级的轨道在半充满状态其原子的电子排布式为________
(3)E元素原子核外有6种不同运动状态的电子,其最高价氧化物的分子的结构式为______,该分子中σ键与π键个数之比为 ,写出与该分子互为等电子体的分子的化学式为 。
下列说法中正确的是
| A.随着原子序数的递增,第三周期元素的电负性逐渐减小 |
| B.铝的第一电离能比镁的第一电离能大 |
| C.K、Na、Li的第一电离能逐渐增大 |
| D.电负性差值大的元素原子之间形成的化学键主要是共价键 |
(1)写出氯原子的原子结构示意图 ,NH4Cl的电子式 ;
(2)用电子式表示H2O的形成过程 ;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量 (填“高”、“低”),故白磷比红磷稳定性 (填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷, 放出热量多。
元素X原子的最外层有1个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物
| A.只能是离子化合物X2Y |
| B.只能是共价化合物X2Y2 |
| C.既可能是离子化合物也可能是共价化合物 |
| D.形成的化合物无论是X2Y还是X2Y2原子都达到了8电子稳定结构 |
以下说法正确的是
| A.金属元素与非金属元素的原子间只形成离子键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.共价化合物内部可能有极性键和非极性键 |
Ⅰ.在①CaCl2、②KOH、③CO2、④NaHSO4、⑤Na2O2、⑥Na2S、⑦N2中,只含有离子键的是________________,只含有共价键的是________________,含有非极性共价键的是__________________,既含有离子键又含有共价键的是____________,属于共价化合物的是____________。
Ⅱ.将NaHSO4溶于水,破坏的化学键是_______________,写出其电离方程式_____________________;NaHSO4在熔融状态下电离,破坏的化学键是_____________,写出其电离方程式____________________。
同主族元素的性质相似,往往可以形成结构和性质相似的化合物,试根据你学过的知识判断。下列有关PH4I(碘化磷)的结构和性质推测结果不正确的是
| A.可由PH3和HI化合而得 |
| B.PH4I在物质分类中属于正盐 |
| C.PH4I对热不稳定,受热时产生气体 |
| D.PH4I属于共价化合物 |
向AgNO3溶液中加入过量氨水,可生成[Ag(NH3)2]OH。下列说法正确的是
| A.氨气极易溶于水,所得的氨水中存在3种不同的氢键 |
| B.[Ag(NH3)2]+中含有6个σ键 |
| C.[Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 |
| D.在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
水是制取氢气的常见原料,下列说法正确的是
| A.H3O+的空间构型为三角锥形 |
| B.冰中存在氢键,液态水中不存在氢键 |
| C.冰晶体中,1 mol水分子可形成4 mol氢键 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
BF3与一定量的水可形成(H2O)2·BF3晶体,结构如下图所示则(H2O)2·BF3晶体中各种微粒间的作用力不涉及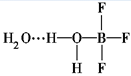
| A.共价键 | B.离子键 |
| C.配位键 | D.范德华力 |
下列关于丙炔(CH3—C≡CH)的说法正确的是
| A.丙炔分子中不存在非极性键 |
| B.丙炔分子中3个碳原子都是sp3杂化 |
| C.丙炔分子中所有的原子都在同一直线上 |
| D.丙炔分子中σ键与π键的个数比为3:1 |
试题篮
()