(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
工业上常用氯氧化法处理含氰(CN-)废水,反应原理为液氯在碱性条件下可以先将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一):KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O;氰酸盐再进一步被液氯氧化为无毒气体。下列说法不正确的是
| A.KCN 与KOCN中氮元素的化合价均为-3价 |
| B.氰酸盐进一步被氧化的产物之一是无毒的N2 |
| C.OCN-与CN-中σ键与π键个数比均为1: 2 |
| D.完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为 。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程 ,B的结构式 。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为 ,其最高价氧化物水化物的化学式为 。
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.1 mol 由元素A、B组成的化合物一定含有18 mole-
B.化合物AE与DE有相同类型的化学键
C.工业上常用电解法制备元素C、D、E的单质
D.元素D的最高价氧化物对应的水化物可以溶于过量的氨水中
CaC2可用于固氮:CaC2+N2 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素。下列判断正确的是
| A.最高价含氧酸酸性:X<Y | B.X、Y、Z可形成离子化合物 |
| C.W可形成双原子分子 | D.M与W形成的化合物含极性共价键 |
(1)某烃A燃烧的化学方程式为:CxHy+(x+ )O2 → xCO2+
)O2 → xCO2+ H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
(2)试分析下列情况下微粒间作用力的变化情况(填“离子键”、“极性键”、“非极性键”或“分子间作用力”)
①MgCl2溶于水时破环 ;
②碘升华破坏 。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的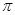 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
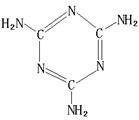
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
X、Y、Z、R、T、U分别代表原子序数依次增大的短周期主族元素。X元素原子的质子数等于其电子层数;Y的基态原子核外电子有5种不同的运动状态;Z与T同主族且原子序数T是Z的两倍;R元素的原子半径在短周期主族元素中最大。请回答下列问题:
(1)Z的基态原子电子排布式为_______;TZ32-离子的空间构型为_______。
(2)T、U的最高价氧化物对应的水化物酸性由强到弱的顺序为__________(填化学式)。
(3)化合物RU的晶体类型为 ;已知RU晶胞体积为Vcm3,RU的摩尔质量为M g/mol则该晶体密度p= (用含V、M的式子表示)。
(4)将Y2X6气体通人H20中反应生成一种酸和一种单质,该反应的化学方程式是 。(已知:Y的电负性为2.0,X的电负性为2.1)
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH
| A.①④⑥⑦⑧ | B.③④⑤⑥⑦ | C.①④⑤⑥⑦⑧ | D.全部 |
下列说法中不正确的是
①水分子的电子式为 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
| A.①② | B.③④ | C.①④ | D.②③ |
(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
试题篮
()