某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是
| A.一定是共价键 | B.一定是离子键 |
| C.可能是共价键,也可能是离子键 | D.以上说法均不正确 |
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是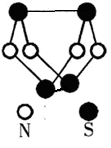
| A.该物质与S2N2互为同素异形体 |
| B.该物质的分子中既有极性键又有非极性键 |
| C.该物质可能是离子化合物 |
| D.该物质的一个分子中含有9个N—S键 |
下列变化过程中,共价键被破坏的是
| A.碘升华 | B.二氧化碳变成干冰 |
| C.氯化氢气体溶于水 | D.碘溶于酒精 |
已知化合物NH5的结构和NH4Cl相似,下列关于NH5的下列说法中正确的是
| A.NH5是共价化合物 |
| B.NH5的电子式为NH4+[∶H]— |
| C.NH5中氢元素呈价+1和-1价 |
| D.NH5与水发生氧化还原反应,置换出氢气 |
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20。则下列说法不正确的是
| A.最高价氧化物的水化物的酸性:X<Z |
| B.原子半径大小:Y<X<W |
| C.氢化物的稳定性X<Y |
| D.X和Y形成的化合物升华破坏的是共价键 |
下列化合物中的化学键中,既有离子键又有共价键的是
| A.H2O | B.NaCl | C.NH4Cl | D.HCl |
下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是
| A.CCl4、SiCl4、SiH4 |
| B.H2S、NF3、CH4 |
| C.BCl3、CH2===CHCl、环已烷 |
| D.SO3、C6H6(苯)、CH3C≡CH |
用杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是
| A.C原子的四个杂化轨道的能量一样 |
| B.C原子的sp3杂化轨道之间夹角一样 |
| C.C原子的4个价电子分别占据4个sp3杂化轨道 |
| D.C原子有1个sp3杂化轨道由孤电子对占据 |
试题篮
()