(14分)
Ⅰ(1)写出表示含有8个质子、10个中子的原子的化学符号 。
(2)元素周期表中,所含元素超过18种的周期是 。
Ⅱ有:①168O、178O、188O ②H2O、D2O ③石墨、金刚石 ④H、D、T 四组微粒或物质,回答下列问题(填序号):
(1)互为同位素的是___________; (2)互为同素异形体的是_______________;
(3)由①和④中微粒能结合成含三个原子的化合物,其中相对分子质量最大的是________(填化学式)。
III(1)用电子式表示Na2S的形成过程: 。
(2)用电子式表示H2O的形成过程: 。
(11分)元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素。Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子。请回答下列问题:
(1)Z在周期表中的位置 ;W基态原于的价电子排布图 。
(2)X、Y、Z、Q中,基态原子第一电离能最大的是 (填元素符号)。
(3)在XQ—中Q的杂化类型为 X的氧化物(X2O)晶体结构示意图如下,则1molX2O晶体含有 mol氢键。
(4)ZY3有较强的还原性,遇到NaClO溶液时有无污染的气体生成,其化学方程式为
A、B、C、D、F属于元素周期表中的短周期元素,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C原子都只有两个电子层,B原子的一个电子层了电子数是另一层的两倍;C的原子的两层电子数之和是两层电子数之差的两倍;D原子的一个电子层的电子数是另两层电子数之和;E的+1价阳离子与C的阴离子有相同的电子层结构。请按要求同答下列问题:
(1)D元素在元素周期表中的位置是 ,写出由A和C组成的原子个数比为1:1的化合物的电子式 。
(2)由上述元素组成的化合物中属于直线型分子是 (只要求写出两种,用化学式表示)。
(3)上述元素形成的化合物中通常能污染空气的是 (至少写出两种),其中有两种污染物有同种元素并能相互反应,该反应的化学方程式为 。反应中氧化产物与还原产物的物质的量之比是 。
(4)写出由B、C、E三种元素组成两种氧化物互相反应有气体生成的化学方程式 ;
(5)由A、B、C、E四种元素形成的化合物的水溶液与过量石灰水反应的离子方程式是: 。
按要求填空:
(1)羟基的电子式是 ;
(2)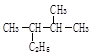 用系统命名法命名为 ;
用系统命名法命名为 ;
(3)2-甲基-1,3-丁二烯的键线式为 ;
(4)乙醛与银氨溶液反应的化学方程式: ____________________。
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的电子式是 ,
该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
(8分,每空1分))有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),
原因是_________________________________________________________________
根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
C的单质分子中π键的数目为________,B.D两元素的气态氢化物的稳定性大小关为________>________(填化学式)。
用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+ Cl
⑵ 写出下列物质的结构式:N2 CO2
⑶ 用电子式表示NaOH_______________________
下列变化中 ①NaCl 溶于水 ②HCl 溶于水 ③O2 溶于水 ④Na2O2溶于水 ⑤I2升华 ⑥固体NaOH熔化。未发生化学键破坏的是 仅发生离子键破坏的是 ,仅发生共价键破坏的是 既发生离子键破坏,又发生共价键破坏的是 (填序号)。
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
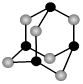
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
【化学-选修3:物质结构与性质】
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;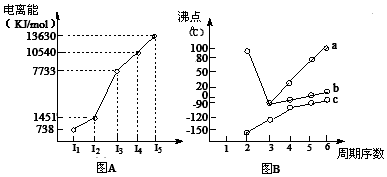
II.图B折线c可以表达出第_________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”);
III.部分有机物的熔沸点见下表: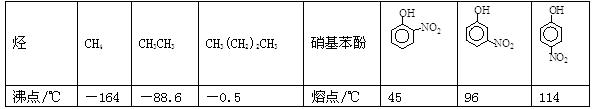
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有______(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为________________________________;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3,
则绿色晶体配合物的化学式为_________________________。
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):[来源*:%z#zstep.^co&m]
①熔化时不需要破坏化学键的是___ _____,熔化时需要破坏共价键的是_____ ___;
②晶体中既有离子键又有共价键的是_____ ___。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为_____ ___。
(2)某元素最高正化合价为+6,其最低负价为_____ ___。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____ ____。
试题篮
()