有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图 ;C2粒子的符号: ;
(2)B、E两种元素形成化合物的电子式:
(3)A、E两种元素形成的氢化物沸点较高的是: (用化学式表示),其原
因是 。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式 。
(15分,除标明外,其余每空2分)铜锰氧化物(CuMnO4)可以在常温下催化氧化空气中的一氧化碳和甲醛,因而对新装修的住房有益。
(1)基态Cu2+的电子排布式为 。
(2)甲醛(HCHO)中C原子的杂化方式为 ,它的空间构型为 ,1mol甲醛分子中含 molσ键。
(3)CO常与金属形成羰基化合物,Fe(CO)5的结构示意图是 ;与CO互为等电子体的分子、离子分别是 、 。
A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的;B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布;D在C的下一周期,可与B形成BD2型离子化合物;E和C为同一周期元素,其最高价氧化物的水化物为强酸。
(1)五种元素的元素符号:A 、B 、C 、D 、E 。
(2)B的原子结构示意图为: ;其在周期表中的位置是第 周期,第 主族。
(3)用电子式表示B与C形成化合物的过程:
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是 。
②熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 。
(2)某元素最高正化合价为+6,其最低负价为 。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 。
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出AB2的电子式为___________。
(2)用电子式表示化合物C2D的形成过程___________________________________。
氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g)
 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正负极电极反应式为_________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
在构成下列物质的微粒中:A氨气,B氯化钡 ,C氯化铵 ,D干冰 ,E苛性钠,F食盐,G冰,H氦气,I过氧化钠,J氢气 。
①只有共价键的是 ;
②只有离子键的是 ;
③既有离子键又有共价键的是 ;
④无任何化学键的是 ;
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是 。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: 。
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
【化学-选修3:物质结构与性质】
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;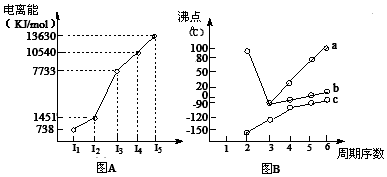
II.图B折线c可以表达出第_________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”);
III.部分有机物的熔沸点见下表: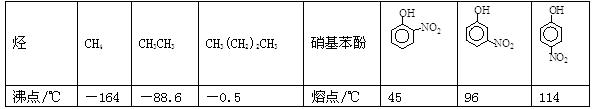
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有______(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为________________________________;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3,
则绿色晶体配合物的化学式为_________________________。
试题篮
()