下列变化中 ①NaCl 溶于水 ②HCl 溶于水 ③O2 溶于水 ④Na2O2溶于水 ⑤I2升华 ⑥固体NaOH熔化。未发生化学键破坏的是 仅发生离子键破坏的是 ,仅发生共价键破坏的是 既发生离子键破坏,又发生共价键破坏的是 (填序号)。
(每空1分,共8分)下列微粒:① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号)
(1)呈正四面体的是 。
(2)中心原子轨道采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 。
杂化的化合物是 。
(3)所有原子共平面的是 ,共线的是 。
(4)微粒存在的配位键的是 。
(5)含有极性键的极性分子是 。
(1)完成下列物质的电子式
| A.Na+, | B.Cl-, | C.H2O, | D.Na2O2 , |
(2)用电子式表示下列化合物的形成过程
H2O ; MgCl2 。
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为______________________,相同温度下的溶解度B____________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA[ |
零 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④[ |
|
⑤ |
⑥ |
|
|
⑦ |
⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
A,B,C,D,E,F,G是元素周期表前四周期元素,原子序数依次增大,根据下表提供的有关信息,回答下列问题
| 元素 |
相关信息 |
| A |
所有单质中密度最小 |
| B |
形成化合物种类最多的元素 |
| D |
基态原子中只有3个能级,有2个未成对电子 |
| E |
短周期中原子半径最大 |
| F |
第三周期中电负性最大的元素 |
| G |
最外层只有一个电子,内层填满电子 |
(1)F元素原子的价电子排布式 ,B,C,D三元素第一电离能由大到小顺序为 (填元素符号)
(2)写出由A,B,C,D四种元素形成的一种简单的既能与酸反应又能与碱反应的化合物
(3)写出由元素E、F形成化合物的水溶液用惰性电极电解的离子方程式
(4)由A,B,C形成的三原子化合物中含有σ键 个,π键 个
(5)已知下列反应:
①G(s) + 1/2O2 (g) =" GO" (s) ; △H=-157.0 KJ/mol
②B(s) + O2 (g) = AO2(g) ; △H=-393.5 KJ/mol
写出单质B与足量GO 反应的热化学方程式
(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:______________________。
(2)在[Fe(CN)6]3-中,中心原子的配位数为__________,配体的立体构型是__________。
(3)配合物[Cr(H2O)4Br2]Br·2H2O中,中心原子的化合价为__________,内界的电荷数为__________。
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
I.下列各组物质:
① 、
、 、
、 ②石墨和C60 ③水和冰
②石墨和C60 ③水和冰
④正戊烷和异戊烷 ⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是 (填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NAF ⑤CO2(干冰) ⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是 (填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
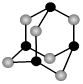
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
【化学-选修3:物质结构与性质】
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;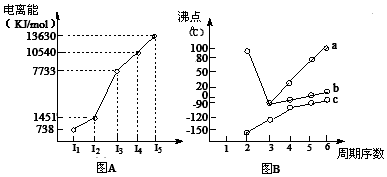
II.图B折线c可以表达出第_________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”);
III.部分有机物的熔沸点见下表: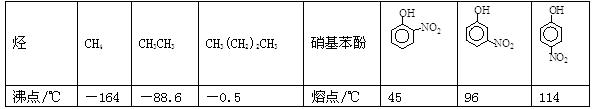
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有______(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为________________________________;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3,
则绿色晶体配合物的化学式为_________________________。
试题篮
()