化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③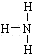 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”或“非极性”)键形成的。
下列各项中表达正确的是
A.NaCl的电子式: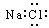 |
B.CO2的分子模型示意图: |
C.CrO5的结构式为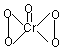 ,该氧化物中Cr为+6价 ,该氧化物中Cr为+6价 |
| D.次氯酸的结构式:H-Cl-O |
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2 ⑧CCl4 ⑨C2H4 ⑩金刚石.用序号填空:
(1)只含有离子键的是 _____;
(2)既含有离子键,又含有极性共价键和配位键的是 _____;
(3)既含有离子键又含有非极性共价键的是 _______;
(4)含有极性共价键和非极性共价键的非极性分子是 _____;
(5)含有极性共价键和非极性共价键的极性分子是 _________;
(6)熔化时只破坏极性共价键的是 _______
化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算确定A的化学式,其中x= ,y= ;
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC、晶体硅、金刚石、SO3
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中含非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是 。
②熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 。
(2)某元素最高正化合价为+6,其最低负价为 。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 。
在构成下列物质的微粒中:A氨气,B氯化钡 ,C氯化铵 ,D干冰 ,E苛性钠,F食盐,G冰,H氦气,I过氧化钠,J氢气 。
①只有共价键的是 ;
②只有离子键的是 ;
③既有离子键又有共价键的是 ;
④无任何化学键的是 ;
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
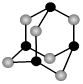
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1 。
试题篮
()