[化学——选修3:物质结构与性质]
碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态14C原子中,核外存在_______________对自旋相反的电子;
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 、C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。


A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的电子排布式
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为
(3)A与B形成的化合物易溶于化合物甲,其主要原因是
(4)甲、乙两分子中含有非极性共价键的是 (填分子式),它中心原子的杂化方式是
(5)已知化合物丁熔点190℃,沸点183℃,结构如右图所示。
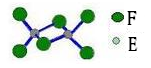
①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为
②则丁含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________;A、B、C的电负性由大到小的顺序为___________;(均用“<”或“>”连接)
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为____________。
(4)E的价层电子排布式是____________,在形成化合物时它的最高化合价为_____________,ECl3形成的配合物的化学式为________________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________。
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)____________ ____。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式: 。
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.NaHCO3溶液
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请回答下列问题(对应元素均用元素符号表示):
(1)C在元素周期表中的位置为 ,G的原子结构示意图是 。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为 ,所含化学键类型为_____。
(3)向甲中滴加足量水时发生反应的化学方程式是 。
(4)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是 。
(5)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的 极,正极的电极反应式为 。
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z单质可制成半导体材料,W与X属于同一主族。完成下列有关问题:
(1)元素X的一种核素含10个中子,该核素可表示为________,X的一种氢化物常用来消毒,该氢化物的电子式为________。元素Z在周期表中的位置是________。
(2)元素X和W的简单氢化物中,沸点高的是________(填化学式),理由是________。
(3)请列举两个事实说明元素W的非金属性比Z强: 。
(4)元素X、Y、Z、W形成的二元化合物(指含两种不同元素的化合物)中,化学键的类型相同的一组化合物的化学式是 。
(5)四种元素的原子半径由大到小的顺序是________(填元素符号)。X、Y、W三种元素的原子形成的简单离子中,半径最小的是________(填离子符号)。
X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为 。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程 ,B的结构式 。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为 ,其最高价氧化物水化物的化学式为 。
下表为元素周期表的一部分,请回答有关问题:
| |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
|
① |
⑥ |
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
|
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)画出①的原子结构示意图: , ⑩的元素名称:
(2)③④⑤原子半径由大到小的顺序是 (填元素符号)
(3)表中最活泼的金属是 ,非金属性最强的元素是 ;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是 ,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式: 。
(5)用电子式表示③与⑥的化合物的形成过程: 。
(1)某烃A燃烧的化学方程式为:CxHy+(x+ )O2 → xCO2+
)O2 → xCO2+ H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
(2)试分析下列情况下微粒间作用力的变化情况(填“离子键”、“极性键”、“非极性键”或“分子间作用力”)
①MgCl2溶于水时破环 ;
②碘升华破坏 。
(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_________填序号),写出反应⑥的化学方程式__ ____。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,
②只有极性共价键的共价化合物是 ,
③只含有非极性共价键的是 ,
④既有离子键又有非极性键的化合物是 。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_________,B为________,C为__________。
(2)E的电子式为_____________。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:_______________。
现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)B在周期表中的位置 。
(2)写出A的氢化物中原子个数为1:1的物质的电子式: 。
(3)写出CD的溶液与氯气反应的离子方程式 。
(4)比较A、B两种元素形成的简单离子半径的大小(用离子符号表示): 。
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);
②D与T;
③16O、17O和18O;
④氧气(O2)与臭氧(O3);
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的 。
(2)是同位素的 。
(3)是同分异构体的 。
Ⅱ.在下列变化中:
①干冰气化
②硝酸钾熔化
③食盐溶于水
④HCl溶于水
⑤蔗糖溶于水
⑥HI分解
用序号填空:
(1)未破坏化学键的是 。
(2)仅离子键被破坏的是 。
(3)仅共价键被破坏的是 。
试题篮
()