组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的原子最外层共有 种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置 。
(2)糖类是人体获得能量的来源之一。已知1mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_ ___。
(3)CO2是一种温室气体,它的电子式为 ,将其转变其他化工原料,必须破坏的化学键属于____.(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+'>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系 。
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 molσ键和 molπ键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
在①HF、②H2S、③BF3、④CS2、⑤CCl4、⑥N2、⑦SO2分子中:
(1)以非极性键结合的非极性分子是___________
(2)以极性键相结合,具有直线型结构的非极性分子是___________
(3)以极性键相结合,具有正四面体结构的非极性分子是___________
(4)以极性键相结合,而且分子极性最大的是___________
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下: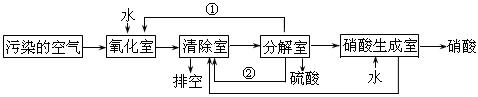
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。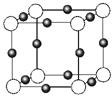
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下: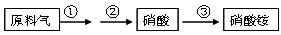
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中 铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔 是有机合成工业的一种原料。工业上曾用
是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可
的电子式可 表示为 ;1mol
表示为 ;1mol  中含有的
中含有的 键数目为_ 。
键数目为_ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为_ 。
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为个.
(2)分子内的
键、分子间的范德华力和氢键从强到弱依次为。
 沸点比
沸点比 高,原因是.
高,原因是.
(3)可与
形成
,
中
原子采用杂化。
中
键角比
中
键角大,原因为。
(4)与
的晶胞同为面心立方结构,已知
晶体密度为ag
 cm-3,
cm-3,表示阿伏加德罗常数,则
晶胞体积为Cm3。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符 号:X 、Y 、Z 、W
号:X 、Y 、Z 、W
(2)X与Y所形成的化合物的化学式为______________,是 化合物。用电子式表示其形成过程________________________ ________________。
________________。
(5分)有下列几种物质:①Ne ②NH4Cl ③NaOH ④Cl2 ⑤KNO3⑥CO2 ⑦H202 ⑧Na2O2
属于共价化合物得是 (填序号,下同),只存在极性键的是 ,既存在极性键又存在非极性键的是 ,既存在极性键又存在离子键的是 ,既存在离子键又存在非极性键的是 。
H2O2、KCl、NaOH、Na2O2、HCl、O2中只含离子键的是 ,只含极性键的是 ,只含非极性键的是 ,既含离子键又含极性键的是 ,既含离子键又含非极性键的是 ,既有极性键又有非极性键的是 。
有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
只含有极性键的是__________;只含有非极性键的是__________;既有极性键,又有非极性键的是______________;只有σ键的是____________;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是__________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是____________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________。
用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
| 分子或离子 |
PbCl2 |
XeF4 |
SnCl62- |
PF3Cl2 |
Hg Cl42- Cl42- |
ClO4-- |
| 空间 构型 |
|
|
|
|
|
|
(4分)下列六种物质的变化中,将合适序号填写在下列空白中:
①干冰的升华; ②硫酸钾熔化; ③NaCl溶于水; ④HCl溶于水; ⑤液氨的受热蒸发; ⑥Na2O2溶于水
(1)仅需要克服分子间作用力的是 。(2)发生离子键破坏,又发生共价键破坏的是 。(3)发生共价键破坏的是 。(4)发生离子键破坏的是 。
试题篮
()