(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
Ⅰ.在①CaCl2、②KOH、③CO2、④NaHSO4、⑤Na2O2、⑥Na2S、⑦N2中,只含有离子键的是________________,只含有共价键的是________________,含有非极性共价键的是__________________,既含有离子键又含有共价键的是____________,属于共价化合物的是____________。
Ⅱ.将NaHSO4溶于水,破坏的化学键是_______________,写出其电离方程式_____________________;NaHSO4在熔融状态下电离,破坏的化学键是_____________,写出其电离方程式____________________。
(1)下列五种物质中,①Ar ② CO2 ③ SiO2 ④ Ba(OH)2 ⑤ K2S,
含有共价键的物质有_______________________________ (填序号)
分别写出 CO2 、 Ba(OH)2的电子式_______________________________
(2)在蔗糖溶液中加入稀硫酸并加热,稀硫酸的作用_____________________________
向上述溶液中加入新制的Cu(OH)2悬浊液,加热未见砖红色沉淀,其原因是_______________________________
(3)请用下列物质的转化或分离方法的序号填空(每一项只填写一种方法)。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取
把煤转化为焦炉气、煤焦油和焦炭等_______________________________
从原油中分离出汽油、煤油、柴油等_______________________________
将重油转化为汽油_______________________________
将海水淡化_______________________________  从海水得到的无水MgC12中提取金属镁
从海水得到的无水MgC12中提取金属镁
(4)乙烯和丙烯(C3H6)既可以分别发生加聚反应形成聚合物,也可以按一定比例相互发生加聚反应形成聚合物。
请写出三种有关聚合物的结构简式 、 、
(5)形成该聚合物  的单体有 ______________________________
的单体有 ______________________________
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。
(1)Y在周期表中的位置是________;X的氢化物与P的氢化物接近时的现象是_________。
(2)W与P可形成原子个数比为1:2的化合物,其电子式为__________。
(3)Y与P形成的化合物溶液显____性;用离子反应方程式表示显这种性质的原因________________。
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是______________________(填化学式)。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。写出此三氟化物与水反应的化学反应方程式_____,若0.6mol X的三氟化物完全与水反应,则转移的电子总数约为_________个。
金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是.
(3)过滤金属配合物的中心原子价电子数与配体提供电子总数之和为18,则
.
与
结构相似,
分子内
键与
键个数之比为.
(4)甲醛()在
催化作用下加氢可得甲醇(
).甲醇分子内
原子的杂化方式为,甲醇分子内的
键角(填"大于""等于"或"小于")甲醛分子内的
键角.
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
【化学选修3:物质结构与性质】
(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2 ,Q基态原子的外围电子(价电子)排布式为 ____ ,T2+的未成对电子数是 ;
(2)中国古代四大发明之一黑火药,它的爆炸反应为S+2KNO3+3C引燃 A+N2↑+3CO2↑ (其中A的化学式未知)
①除S外,上列元素的电负性从大到小依次为 ___________ 。
②在生成物中,A的晶体类型为_______;CO2中心原子轨道的杂化类型是_______。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为_____ 。
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|
|
|||||
| |
|
|
b |
c |
d |
|
|
| e |
|
f |
|
|
g |
|
|
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
(8分每空1分)
(1)下列3种不同粒子 H、
H、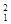 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素, H、
H、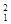 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C. |
D. |
(3)写出电子式:(1)OH—: ;(2)N2: ;
(3)K2O: ;(4)CO2: 。
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。N是一种“明星金属”,广泛应用于航天、军事等工业领域。请回答下列问题:
⑴X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。
⑵X的氢化物易溶于水的其原因是: 。
⑶N的电子排布式是: 。
⑷X和Y两元素的第一电离能大小关系: 小于 (填元素符号)。
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+ Cl
⑵ 写出下列物质的结构式:N2 CO2
⑶ 用电子式表示NaOH_______________________
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104 kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
试题篮
()