下表为元素周期表的一部分,请参照元素A-K在表中的位置,
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
B |
C |
D |
|
|
| 3 |
E |
|
F |
G |
|
|
K |
|
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。
(共11分)根据所学知识填空:
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_ ,基态原子核外电子排布式 。该元素在周期表中的位置 。
(2)氯酸钾熔化,粒子间克服了________;二氧化硅熔化,粒子间克服了________;碘的升华,粒子间克服了________。
a、离子键 b、共价键 c、分子间作用力 d、金属键
(3)在①金刚石 ②(NH4)2SO4 ③SiC ④CO2 ⑤H2O中,存在极性键共价键的化合物_____,由极性键形成的非极性分子有________,能形成分子晶体的物质是________,这五种物质的熔点从大到小的顺序(填序号)
(4)下列分子中若有手性原子,请用“*”标出其手性碳原子。

元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是: 。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ,析出该复盐晶体的原理是 。
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:
2H2O2(l)  2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
H2(g)+1/2O2(g)  H2O(l) ΔH2 =-285.84 kJ·mol-1
H2O(l) ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g)  2HCl(g) ΔH3 =-184.60 kJ·mol-1
2HCl(g) ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD2的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: .
(本题15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 |
氟 |
氧 |
溴 |
碘 |
铍 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2
 。
。 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号)
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式)
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为 ;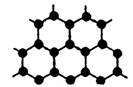
(4)D的水合醋酸盐晶体局部结构如右图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键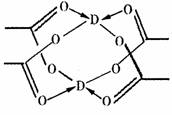
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1) C、D两元素形成的化合物的晶体类型是 。BC2的结构式
(2)若F是D的同主族下一周期元素,则F的电子排布式是:
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。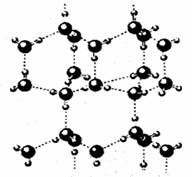
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____ 分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有 (填序号)。
A 配位键 B 极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是 。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是___ __(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为_______ _(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为____ _。
短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Y、Z、W形成的某种化合物晶体类型是 (填“晶体类型”名称)。
(5)X和Y形成的化合物沸点比X和W形成的化合物沸点 (填“高”或“低”)。
(6)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
现有①BaCl2 ②金刚石 ③碘片 ④冰 ⑤Na2SO4五种物质,按下列要求回答(填编号)
(1)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 ;
(2)只有离子键的物质是 ,含有共价键的离子化合物是 。
(16分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式 ,A物质中的化学键类型 ,B的电子式 。
(2)写出下列反应的化学方程式:
D+G→H ;
F+J→B+C+I ;
(3)0.3mol I与足量C反应转移电子的物质的量为 mol
(4)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36。已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol—1 |
I1 |
I2 |
I3 |
I4 |
| X |
496 |
4562 |
6912 |
9543 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
578 |
1817 |
2745 |
11578 |
(1)X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于Z的原因是 。
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
①W元素基态原子价电子排布式为 。
②已知CN—与 分子互为等电子体,1molCN—中 键数目为 。
键数目为 。
③上述沉淀溶解过程的化学方程式为 。
(14分)硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有滑腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:

(1)B原子结构示意图为_______________________。
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
(3)下列有关硼酸晶体的说法正确的是_______________。
A、H3BO3分子的稳定性与氢键有关
B、平均1 mol H3BO3的晶体中有3 mol氢键
C、硼酸晶体中层与层之间作用力是范德华力
D、B为sp2杂化,同一层内主要作用力是共价键和氢键
(4)根据对角线规则,与B性质相似的元素是________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是______。
A HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=______;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数):
____________________________________________________________。
试题篮
()