(8分,每空1分))有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),
原因是_________________________________________________________________
根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
C的单质分子中π键的数目为________,B.D两元素的气态氢化物的稳定性大小关为________>________(填化学式)。
(1)可正确表示原子轨道的是: 。
| A.2s | B.2d | C.3p | D.3f |
(2)镓(Ga)原子序数为 ,写出其基态原子的电子排布式: 。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。
(4)用“>” “< ” “=” 填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
(5)NO3-的空间构型为 (用文字描述)。
(6)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 。CO与N2结构相似,CO分子内σ键与π键个数之比为 。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③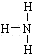 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
.根据要求的化学用语填写
(1)H2O2的电子式为_______________
(2)C2H2的结构式为__________________
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式__________________________________________________________________
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为__________________________________,负极反应式为____________________________
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。它的电子式是____________________
下表是元素周期表的一部分,表中所列字母分别代表一种化学元素。请用元素符号等化学用语回答下列有关问题:
(1)上述元素中第一电离能最大的元素是 ,C、D、E、F四种元素第一电离能由大到小的顺序 。
(2)由A、C、D形成的ACD分子中,σ键个数∶π键个数=________。
(3)要证明太阳上是否含有R 元素,可采用的方法是 。
(4)能够说明K、F两元素非金属性强弱的事实是 ;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是_____(填“极性”或“非极性”)分子。
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,
其原因是 。
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是 ;有关反应的离子方程式为 。
A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 。
(2)写出化合物E2F2的电子式 ,化合物ABC的结构式 。
(3)根据题目要求完成以下填空:
BF32-中心原子杂化方式 ;D3中心原子杂化方式 ;
FD42-微粒中的键角 ;FD3分子的立体构型 。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有 、 (要求写一种分子和一种离子)。
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是 。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: 。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”或“非极性”)键形成的。
(共4分)下列五种物质中 ①Ne ②H2O ③NH3 ④KOH ⑤Na2O(填写序号):只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式 ,中心原子杂化方式是 .
(2)三角锥形分子:分子式 ,VSEPR模型的名称为 .
(3)正四面体形分子:结构式
(4)与O22+互为等电子体的一种化合物的分子式为 ,O22+的电子式可表示为_____,1mol O22+ 中含有的 键数目为_____。
键数目为_____。
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g)
 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是 。
②熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 。
(2)某元素最高正化合价为+6,其最低负价为 。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 。
试题篮
()