(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是_____________。
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A.加入适量的氯化铵晶体后,两溶液的pH均减小 | B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 | D.用盐酸中和,消耗的盐酸体积相同 |
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.Na2CO3和HCl |
同物质的量浓度下列溶液 ①  ②Na2CO3③CH3COONa ④NaOH ⑤H2SO4
②Na2CO3③CH3COONa ④NaOH ⑤H2SO4
⑥HCl ⑦Ba(OH)2⑧KCl,这八种溶液对水电离程度的影响由大到小的顺序正确的是:
| A.②>①>③>⑧>④=⑥>⑤=⑦ | B.②>①>③>⑧>④>⑥>⑤>⑦ |
| C.①>②>③>⑧>④=⑥>⑤=⑦ | D.②>①>③>⑧>⑤=⑦>④=⑥ |
将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105 mol·L-1、c(Al3+)=0.055mol·L-1,c(H+)="0.01" mol·L-1 (假设溶液中硫酸完全电离为H+和SO42-),则c(K+)为 ( )
| A.0.045mol·L-1 | B.0.035mol·L-1 | C.0.055mol·L-1 | D.0.040mol·L-1 |
下列关于电解质溶液的叙述正确的是 ( )
A.常温下,Ph=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:   |
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
C.室温下,CH3COOH分子可存在于pH=8的碱性溶液中 |
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是
A.c(K+)>c(Na+)>c(H+)>c(OH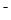 ) ) |
B.c(Na+)+c(K+)+c(H+)=c(SO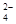 )+c(HS )+c(HS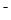 )+c(OH )+c(OH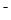 )+c(S2一) )+c(S2一) |
C.c(SO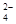 )>c(HS )>c(HS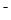 )>c(OH )>c(OH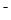 )>c(H+) )>c(H+) |
D.c(K+)=c(S2一)+c(H2S)+c(HS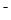 )+c(SO )+c(SO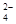 ) ) |
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。请回答下列问题: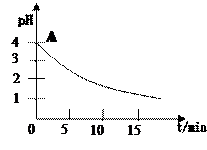
①电解前氯化铜溶液的pH值处于A点位置的原因是: (用离子方程式说明)。
②“理论派”所持观点的理论依据是: 。
③“实验派”的实验结论是 ,他们所述“精确实验”是通过
确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述) 。
:已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH— )= 1×10-3 mol· L-1碱溶液等体积混合后,溶液呈酸性。其原因可能是 ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
分析:题中两溶液中的c(H+)= c(OH— ),采用中和假想法,若是强酸强碱等体积混合,溶液一定呈中性。现溶液呈酸性,说明酸过量,且必须是弱酸。以此得答案B。
注意:中和反应后溶液的酸碱性由两方面决定。该题给出c(H+)= c(OH—),故应从酸碱用量考虑。如未理解题意,极易从盐的水解进行分析,故易错选C、D。
若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为( )
| A.10:1 | B.5:1 | C.1:1 | D.1:10 |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( C )
| A.9.0 | B.9.5 | C.10.5 | D.11.0 |
常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
| A.pH ="12" 的Ba(OH)2 | B.pH =12的氨水 |
| C.0.005mol/L NaOH | D.0.05mol/LBaCl2 |
试题篮
()