一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·[c(OH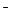 )]2=KSP,其中KSP为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
)]2=KSP,其中KSP为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
①0.1mol·L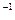 AlCl3溶液 ②0.1mol·L
AlCl3溶液 ②0.1mol·L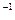 NH4C1溶液
NH4C1溶液
③0.1mol·L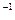 KCl溶液 ④0.1mol·L
KCl溶液 ④0.1mol·L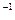 KAlO2溶液
KAlO2溶液
| A.①④③② | B.①②③④ | C.③①④② | D.④①③② |
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
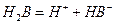

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
已知H2B在水溶液中存在以下电离:

 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
 (4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
下列溶液一定呈中性的是 ( )
| A.pH=7的溶液 |
| B.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 |
| C.PH=2的CH3COOH和PH=12的NaOH溶液等体积混合 |
| D.CH3COONa溶液 |
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
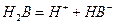

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
下列有关溶液的叙述正确的是
| A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1 |
| B.在pH=2的醋酸溶液中加入等体积c(酸)=2mol·L-1的某酸溶液后,混合溶液的pH一定会减小 |
| C.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液的m倍和n倍,若稀释后两溶液的pH仍相同,则m>n |
| D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) =" b" mol。则a、b正确的答案组合是
| A.9~11之间;0.1 | B.9~11之间;0.2 |
| C.12~13之间;0.2 | D.13;0.1 |
把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:
Ca(OH)2(s)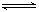 Ca2++2OH- 加入以下溶液,可使Ca(OH)2减少的是
Ca2++2OH- 加入以下溶液,可使Ca(OH)2减少的是
| A.Na2S溶液 | B.AlCl3溶液 | C.NaOH溶液 | D.CaCl2溶液 |
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
| A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多 |
| B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取 |
| C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 |
| D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是( )
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-) | B.c(HC2O4-)+ c(C2O42-)=0.1mol/L |
| C.c(C2O42-)>c(H2C2O4) | D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-) |
已知室温时,0.1某一元酸HA在水中有0.1
发生电离,下列叙述错误的是:()

| A. |
该溶液的 |
| B. |
升高温度,溶液的 |
| C. |
此酸的电离平衡常数约为1×10-7 |
| D. |
由 |
下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是溶液分别滴定
溶液和
溶液的滴定曲线示意图。下列示意图中,能正确表示用
·
溶液滴定
和
混合溶液的滴定曲线的是()

| A. |
|
| B. |
|
| C. |
|
| D. |
|
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A. |
在
|
| B. |
|
| C. |
10
|
| D. |
中和体积与
|
试题篮
()