下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe (SO4)2溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl)
已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A、c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B、c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C、c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D、c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
关于下列各比较对象,前者一定大于后者的是
A.将pH均为11的NaOH溶液和氨水溶液分别稀释成pH=10的溶液,所加水的量
B.物质的量浓度相等的Na2CO3溶液与(NH4)2CO3溶液中CO3 的物质的量浓度
的物质的量浓度
C. 常温下pH=5的NaHA溶液中c(H2A)与c(A )
)
D. 等浓度的氯化钠和苯酚钠溶液中水的电离程度
下列说法中不正确的是 ( )
| A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性 |
| B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+) |
| C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l |
| D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解 |
在25℃时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合,下列有关所得溶液的说法中错误的是
| A.溶液一定呈酸性 |
| B.向反应后的溶液中加入几滴稀盐酸,溶液的pH变化不大 |
| C.溶液中可能存在:c (H+) = c (CH3COO-)+c (OH-) |
| D.设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:Ka·Kh=Kw |
下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③ |
| B.将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+ c(H2C2O4) |
| C.0.1mol·L-1 K2HPO4和0.2mol/L KH2PO4的混合溶液:c(K+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-) |
| D.0.1mol·L-1 CH3COONa与0.15mol·L-1 HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
下列溶液中微粒的物质的量浓度关系正确的是
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: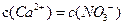 |
| B.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A- 为酸根离子):c(Na+)>c(AlO2-)>c(C1-)>c(0H-) |
| C.0.1 mol/L-1NaAl02溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中: |
2c(OH-)=2c(H+)+c(CH3COOH)
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶 液已经变质 |
| B.向皂化反应后的混合物中加入食盐可分离出高级脂肪酸钠,说明高级脂肪酸钠在 此时容易析出 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:  |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成 |
Cu(OH)2沉淀,说明
25℃时,下列关于分别由等体积0.1 mo1/L的2种溶液混合而成的溶液的说法中,不正确的是 ( )
| A.Ba(OH)2溶液与Na2SO4溶液:pH=13 |
| B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO一)+c(OH一) |
C.Na2CO3溶液与NaOH溶液:c(Na+)>c( CO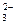 )>c(OH一)>c(H+) )>c(OH一)>c(H+) |
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)= 3c(CO 3c(CO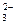 )+3c(HCO )+3c(HCO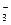 )+3c(H2CO3) )+3c(H2CO3) |
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下: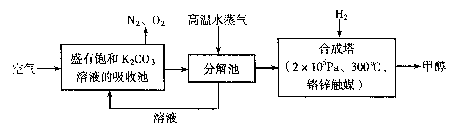
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。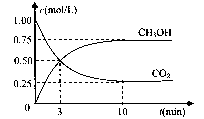
①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
已知2Fe2+ +Br2=2Fe3++2Br-。向10mL0.1mol·L-1的FeBr2溶液中通入0.001mol Cl2,反应后的溶液中,除含有Cl—外还一定( )
| A.含Fe2+,不含Fe3+ | B.含Fe3+,不含Br- |
| C.含Fe3+,含有Br- | D.含Fe2+,含有Fe3+ |
关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是( )
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
C.①和②等体积混合后的溶液: c(OH )=c(H+)+ c(CH3COOH) )=c(H+)+ c(CH3COOH) |
| D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
25 ℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是
| A.a=12.5,且混合溶液pH=7 |
| B.对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| D.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
试题篮
()