常温时,下列说法正确的是
| A.pH=5的NH4Cl溶液中,由水电离出的c(H+)为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.在c(H+):c(OH-)=1:1012的溶液中,Na+、I-、NO3-、SO32-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
已知25℃时:
① NH4+ (aq)+OH-(aq)=NH3·H2O(aq) ΔH="a" kJ·mol-1
② NH4+ (aq)+H2O(1)  NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
A.水电离过程的热化学方程式可表示为:H2O(1)  H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol |
| B.当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 |
| D.当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
室温下,下列叙述正确的是(溶液体积变化忽略不计)
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.将等体积的①和③混合,所得溶液中c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
下列说法正确的是
| A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO3—、Cl-、CO32—、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是( )。
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2 |
| D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
关于下列各图的叙述正确的是
A.甲中△H1=△H2+△H3
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列图示与对应的叙述不相符的是
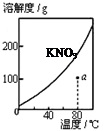
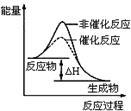
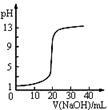
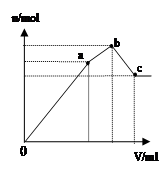
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
下列叙述中正确的是
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
试题篮
()