已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .① B .②③ C.②④ D.③④
下列有关说法正确的是
| A.将Al2(SO4)3溶液蒸干得到Al2(SO4)3固体 |
| B.用广泛pH试纸测得某溶液pH为11.3 |
| C.向纯水通入少量HCl气体,水的电离程度减小,Kw减小 |
| D.向0.1 mol·L-1 CH3COOH溶液中加少量水,溶液中所有离子的浓度都减小 |
25℃时,将1 mol NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
| A.滴加氨水的过程中,水的电离平衡将正向移动 |
| B.滴加b L氨水后的溶液中,n(NH4+) = 200 n(NH3·H2O) = 1 mol |
| C.所滴加氨水的浓度为0.005 / b mol·L-1 |
| D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+) = c(NO3-) > c(H+) = c(OH-) |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
关于溶液的下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH- |
| B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-) |
| C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
下列关于常温下电解质溶液的叙述中,正确的是( )
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol·L-1NaX溶液中由水电离出的c (OH-)=1×10-8mol·L-1 |
下列判断不正确的是
A.0.1mol/L的NaHA溶液其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
C.pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:c(H+)+c(M+)=c(OH-)+c(A-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
下列有关叙述正确的是 ( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中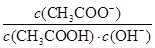 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与a mol·L-1 NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+)、c(Na+)>c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+) = c(OH-)+c(HCO3-)+c(CO32-)
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+2c(OH-) = 2c(H+) + c(CH3COO-)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
下列叙述正确的是( )
| A.在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变 |
| B.Na2CO3溶液加水稀释后再恢复至原温度, pH和KW均减小 |
| C.室温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)之比104:1 |
| D.25℃,若测知氨水与NH4Cl混合溶液的pH>7,则溶液中c(NH4+)>c(Cl—) |
现有浓度均为0.10mol·L-1的醋酸V1 mL和氢氧化钠溶液V2 mL,下列说法正确的是
| A.常温下,上述溶液中,醋酸溶液的pH=1,氢氧化钠溶液的pH=13 |
| B.常温下,若两溶液混合后pH=7,则混合液:c(Na+)=c(CH3COO-) |
| C.若 V1= V2,将两溶液混合,所得混合液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.V1与V2任意比混合,所得混合液:c (Na+)+ c(H+) =c(OH-)+ c (CH3COO-) |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3‑)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能
为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
| A.①②③⑥ | B.③④⑤⑥ | C.②④⑤⑥ | D.①③④⑤ |
试题篮
()