下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液c(Na+)=c(NO3-) |
25℃时,水中存在电离平衡:H2O  H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)= 0时,c(H+)="1" × 10-2 mol/L |
| B.V(NaOH)< 10 mL时,不可能存在c(Na+)=" 2" c(C2O42-)+ c(HC2O4-) |
| C.V(NaOH)=" 10" mL时,c(H+)="1" × 10-7mol/L |
| D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-) |
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.0l×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
| A.②③ | B.②④ | C.③④ | D.①③ |
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是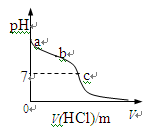
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列叙述错误的是
| A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度 |
B.Al3+的水解方程式为 Al3+ + 3H2O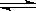 Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| C.NaHSO4在水溶液中的电离方程式为 NaHSO4 =" Na+" + H+ + SO42- |
| D.H2CO3的电离方程式为 H2CO3 =" H+" + HCO3- |
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的Cl-浓度相等的是 ( )
| A.150 mL 1 mol/L NaCl溶液 | B.75 mL 2 mol/L CaCl2溶液 |
| C.150 mL 2 mol/L KCl溶液 | D.75 mL 1 mol/LAlCl3溶液 |
某工厂排放的酸性废水中含有较多量的重金属cu2+,这对农作物和人畜均有害。欲采用化学药剂法除掉有害成分,应选择下列药品中的( )
| A.食盐和硫酸 | B.铁粉和生石灰 |
| C.胆矾和石灰水 | D.苏打和硫酸 |
在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是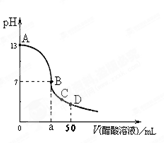
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
| A.自来水 | B.0.5 mol·L-1盐酸 | C.0.5 mol·L-1醋酸溶液 | D.0.5 mol·L-1 KCl溶液 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A.NaOH(固体) | B.H2O | C.NH4Cl(固体) | D.CH3COONa(固体) |
下列溶液一定呈碱性的是
| A.溶液中c(OH-)>c(H+) | B.溶液中含有OH‑离子 |
| C.滴加甲基橙后溶液显红色 | D.滴加甲基橙后溶液显黄色 |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH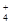 )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
下列各选项中所述的两个量,前者一定大于后者的是( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
试题篮
()