一定温度下,向质量分数为a的乙腈(CH3CN)溶液中加入等体积水,所得溶液中乙腈质量分数为0.4a,则乙腈的密度(ρ1)与水的密度(ρ2)的关系是
| A.ρ1>ρ2 | B.ρ1=ρ2 | C.ρ1<ρ2 | D.无法确定 |
常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )。
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH一定为14-a
已知:H+(aq) + OH-(aq) = H2O(l) △H =-57.3 kJ·mol-1。
对于下列反应:
①HCl(aq) + NH3·H2O(aq) = NH4Cl(aq) + H2O(l) △H =-a kJ·mol-1
②HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) △H =-b kJ·mol-1[
则a、b的大小关系为
| A.a>b | B.b>a | C.a = b | D.无法比较 |
下列有关溶液的叙述错误的是
| A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1 |
| B.常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol·L-1,则该溶液可能为NaOH溶液 |
| C.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比小于2∶1 |
| D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
在-50 ℃时液氨中有2NH3(液)  NH+NH电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH+NH电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
| A.电离平衡常数是1×10-15 |
| B.不加入其他物质,液氨中c(NH)=c(NH) |
| C.降低温度,其电离平衡常数数值增加 |
| D.此液氨中放入NH4Cl,其电离平衡常数的数值增加 |
等体积,浓度均为0.1mol/L的三种溶液:
①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积[(v)随时间(t)变化的示意图所示,
下列说法正确的是
| A.物质酸性的比较:CH3COOH>HSCN>H2CO3 |
| B.反应结束后所得两溶液中,c(CH3COO—)>c(SCN—) |
| C.上述三种溶液中由水电离的c(OH—)大小:NaHCO3>CH3COOH>HSCN |
| D.CH3COOH溶液和NaHCO3溶液反应所得溶液中: |
c(CH3COO—)+c(CH3COOH)=0.10mol·L-1
有①Na2SO3溶液②CH3COOH溶液③HCl溶液各25 mL,物质的量浓度均为0.1 mol/L。下列说法正确的是( )
| A.三种溶液的pH的大小顺序是①﹥②﹥③ |
| B.三种溶液稀释相同倍数,pH变化最大的是① |
| C.三种溶液中含微粒种类多少顺序是:②﹥①﹥③ |
| D.三种溶液中由水电离出c(H+)大小顺序是:③﹥②﹥① |
下列叙述正确的是( )
| A.95℃纯水的pH﹤7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2 mol/L的盐酸与等体积水混合后pH=1 |
| D.pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合后pH=7 |
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是 ( )。
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
下列溶液中Cl-浓度最小的是
| A.200mL 2mol/L MgCl2溶液 | B.1000mL 2.5mol/L NaCl溶液 |
| C.250mL 1mol/L AlCl3溶液 | D.300mL 5mol/L KClO3溶液 |
今有室温下四种溶液,有关叙述不正确的是
| |
① |
② |
③ |
④ |
| 浓度c/mol/L |
0.1 |
0.1 |
0.1 |
0.1 |
| 溶液 |
氨水 |
CH3COONa溶液 |
醋酸 |
盐酸 |
| A.在20mL①溶液中逐滴加入③溶液,溶液导电能力变化如下图(1)所示 |
| B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
C.用③滴定①,用酚酞作指示剂,滴定曲线如下图(2)所示: |
| D.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列说法正确的是
| A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同 |
| B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7 |
| C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 |
| D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |
下列图像表达正确的是( )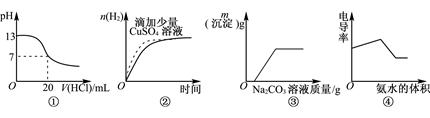
| A.图①表示25℃时,和0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
试题篮
()