下列说法正确的是
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAl(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2 |
| D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
下列说法或表述正确的是
| A.由水电离产生的c(H+)=1×10-2mol•L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为: 3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓ |
| D.物质的量浓度均为1 mol•L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
下列叙述正确的是
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性 |
| B.相同温度下,完全中和相同PH、相同体积的氨水和NaOH溶液,所需相同浓度的盐酸体积相等 |
| C.0.1mol·L-1的酸式盐NaHA溶液中,c(Na+)=0.1mol·L-1≥c(A2-) |
D.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下 |
下列叙述正确的是
| A.当温度升高时,弱酸的电离平衡常数Ka变小 |
| B.某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)=10-7mol·L-1 |
| C.pH=12氨水与pH=2盐酸等体积混合,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中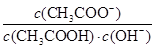 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=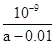 |
关于电解质溶液下列说法中不正确的是
A.向浓度均为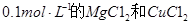 混合溶液中逐滴加入氨水,先生成蓝色 混合溶液中逐滴加入氨水,先生成蓝色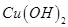 沉淀,则 沉淀,则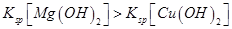 |
| B.用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍 |
C.由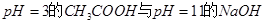 溶液等体积混合,其离子浓度的顺序为: 溶液等体积混合,其离子浓度的顺序为: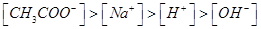 |
D.某温度下纯水中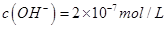 ,则该温度下0.1mol/L的盐酸的pH=1 ,则该温度下0.1mol/L的盐酸的pH=1 |
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,下表各组关系可能合理的是
| 编号 |
HX |
YOH |
溶液体积 |
粒子浓度 |
| ① |
强酸 |
强碱 |
V(HX)=" V" (YOH) |
c(HX) + c(X-) = c(Y+) |
| ② |
弱酸 |
弱碱 |
V(HX)<V(YOH) |
c(X-) < c(Y+) |
| ③ |
强酸 |
强碱 |
V(HX)= V(YOH) |
c(H+)>c(YOH) + c(OH-) |
| ④ |
弱酸 |
弱碱 |
V(HX)>V(YOH) |
c(Y+) + c(H+) = c(X-) + c(OH-) |
A.①② B.②③ C.②④ D.③④
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
常温下,0.1mol/L氨水溶液中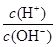 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
| A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L |
| B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+) |
| C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是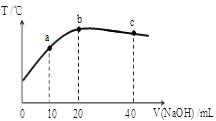
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH—):b点>c点 |
| C.从a点到b点,混合溶液中可能存在:c(CH3COO—)= c(Na+) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO—)>c(OH—)>c(H+) |
下列判断正确的是
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH—)
C.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液恢复原状,则只需向电解液中通入一定量的HCl气体
下列关于电解质溶液的叙述正确的是
| A.常温下,Na2CO3溶液的pH>7 |
| B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应 |
| C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为: c(Cl-)=c(NH4+)>c(H+)=c(OH一) |
| D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同 |
试题篮
()