下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低 |
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是:( )
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合后,溶液中有c(Cl-)>c(NH4+) >c(H+) >c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .① B .②③ C.②④ D.③④
下列说法正确的是:
| A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) |
| B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2 |
C.常温下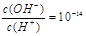 的溶液中存在Al3+、NH4+、Cl-、NO3- 的溶液中存在Al3+、NH4+、Cl-、NO3- |
| D.已知: |
| 共价键 |
C—C |
C=C |
C—H |
H—H |
| 键能/kJ·mol-1 |
348 |
610 |
413 |
436 |
由上表数据可以计算出反应 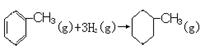 的焓变
的焓变
工业上常用还原沉淀法处理含铬废水(Cr2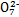 和Cr
和Cr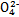 ),其流为:
),其流为:
Cr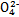
 Cr2
Cr2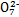
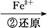 Cr3+
Cr3+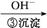 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr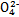 (黄色)+2H+
(黄色)+2H+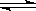 Cr2
Cr2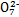 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 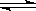 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr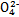 浓度增大 浓度增大 |
B.步骤①中当2v(Cr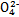 )=v(Cr2 )=v(Cr2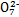 )时,说明反应2Cr )时,说明反应2Cr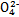 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| |
① |
② |
③ |
④ |
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为A→B→ (填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是 。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是 。
Ⅱ.标定FeSO4溶液的浓度
(1)用滴定管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为 ,据此可测得FeSO4溶液的物质的量浓度为 mol·L-1。
(2)滴定时选用 (A.石蕊B.酚酞C.不用指示剂,填字母)为指示剂,理由是 。
有下列物质①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤Ba(OH)2溶液;⑥熔融NaCl;⑦稀氨水;⑧BaSO4;⑨H2O
(1)属于强电解质的是 (填序号) 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
下列对于溶液中的问题叙述正确的是( )
| A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ |
| C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
25℃时,弱酸的电离平衡常数如下表:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| Ka |
1.8×10-5 |
4.9×10-10 |
K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是____________
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
(2)0.1 mol·L-1的NaHCO3溶液中存在的平衡有(用离子方程式表示)_____________。
(3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是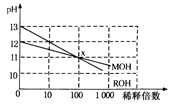
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
(4)AgCl在溶液中存在如下平衡: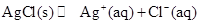 在25℃时,AgCl的
在25℃时,AgCl的
Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3
mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+
浓度由大到小的顺序为_____________(填序号),向50 mL 0.018 mol/L的AgNO3溶液中加
入50 mL 0.02 mol/L的盐酸,沉淀生成后溶液中c(Ag+)是________mol/L。如果向生成沉淀
后的溶液中再加入50 mL 0.001 mol/L的盐酸,是否产生沉淀_______(填“是”或“否”)。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中[Na+]、[CH3COO-]的大小关系为:[Na+]________[CH3COO-]。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________。
根据下表数据,下列判断正确的是
| 电离常数(25℃) |
| HF: Ki =" 3.6×10" - 4 |
| H3PO4: Ki1=" 7.5×10" -3, Ki2=" " 6.2×10 -8, Ki3=" " 2.2×10 -13 |
A. 在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-= H2PO4-+HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合H+ 的能力:H2PO4-> HPO42->F-
试题篮
()