向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
| A.Va<Vb时:c (CH3COOH) +c (CH3COO-)>c (K+) | |
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-) |
C.Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+) |
| D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-) |
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (填字母序号,多选倒扣分)。
a.装HCl的试管中放出H2的速率快;
b.装HA溶液的试管中入出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
已知H2A在水中存在以下平衡:H2A H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是_____________________________ ___。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2·L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c (Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)  Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________
下列说法正确的是
| A.对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值小于HX溶液的pH改变值 |
| B.在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 |
| C.在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-) |
D.沉淀溶解平衡AgI Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 |
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
将稀硝酸与稀氨水混合,不可能出现的结果是 ( )
| A.pH=7,且c(NH4+)=c(NO3-)>c(H+)=c(OH-) |
| B.pH<7,且c(NO3-)+c(OH-)=c(H+)+c(NH4+) |
| C.pH<7,且c(H+)>c(NO3-)>c(OH-)>c(NH4+) |
| D.pH>7,且c(NH4+)>c(OH-)>c(NO3-)>c(H+) |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列说法正确的是
| A.Na2CO3溶液中c(Na+)与c(CO32—)之比为2:1 |
| B.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| C.0.2 mol•L-1与0.1mol/L醋酸中c(H+)之比为2:1 |
| D.相同体积的0.1 mol•L-1盐酸和0.1mol/L醋酸分别与足量镁条反应,放出H2的体积比大于1:1 |
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。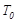 ℃时,将2mol
℃时,将2mol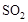 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中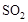 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。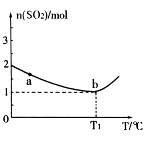
①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内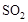 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③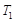 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知混合溶液中
c(CN-)﹤c(Na+),则下列关系中,正确的是
| A.c(Na+)﹥c(CN-)﹥H+ ()﹥c(OH-) | B.c(HCN)+c(CN-)=0.04mol·L-1 |
| C.c(Na+)+c(H+)=c(CN-)+c(OH-) | D.c(CN-)﹥c(HCN) |
下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH) < c(NaHCO3) <c(CH3COONa)
B.已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol·L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6. 0×10-10mol·L-1
C.25℃时,0.1mol·L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol·L-1NaOH溶液中水电离出来的c(OH-)
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-) >c(H+)>c(H2A)>c(A2-)
根据下表数据,下列判断正确的是
| 电离常数(25℃) |
| HF: Ki =" 3.6×10" - 4 |
| H3PO4: Ki1=" 7.5×10" -3, Ki2=" " 6.2×10 -8, Ki3=" " 2.2×10 -13 |
A. 在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-= H2PO4-+HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合H+ 的能力:H2PO4-> HPO42->F-
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
[B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
Ki1=4.4×10-7 Ki2=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.醋酸滴入碳酸钠溶液中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较, pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
试题篮
()