常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: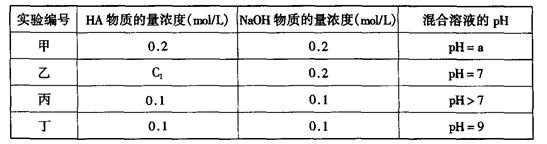 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH—)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A—)= mol/L
将一定质量的Mg、Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,加1mol/L的NaOH溶液得下图关系。


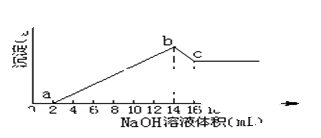
(1)求Mg, Al质量各是多少?
(2)求盐酸的物质的量浓度为多少mol/L?
将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为
| A.0.3 mol·L-1 | B.0.03 mol·L-1 |
| C.0.05 mol·L-1 | D.0.04 mol·L-1 |
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42-
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 pH=9的NH3·H2O中水的电离程度。(填 “>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则[Na+]+[NH4+] 2[SO42-](填 “>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。(填“>”、“=”或“<” )
(3)将分别含有MnO4-、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH值,使pH=1,
充分反应后:
①若I-离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是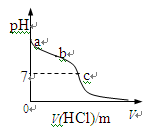
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列说法不正确的是
| A.凡是铵盐均能与苛性钠共热产生氨气 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.将二氧化硫通入溴水,溴水退色后加热不能恢复原色 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
下列说法错误的是( )
| A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 |
| D.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
200 ml Fe2(SO4)3溶液中含Fe3+ 56g,溶液中SO42—的物质的量浓度是( )
| A.5mol/L | B.7.5 mol/L | C.10 mol/L | D.2.5 mol/L |
密度为0.91 g·cm-3的氨水,质量分数为25%,若将此氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
| A.大于12.5% | B.小于12.5% |
| C.等于12.5% | D.无法确定 |
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是 ( )
| A.2 mol·L-1H2SO4溶液 |
| B.18 mol·L-1H2SO4溶液 |
| C.6 mol·L-1KOH溶液 |
| D.3 mol·L-1HNO3溶液 |
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的Cl-浓度相等的是 ( )
| A.150 mL 1 mol/L NaCl溶液 | B.75 mL 2 mol/L CaCl2溶液 |
| C.150 mL 2 mol/L KCl溶液 | D.75 mL 1 mol/LAlCl3溶液 |
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是 ( )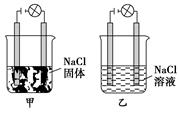
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl是弱电解质 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
试题篮
()