下列有关溶液中微粒浓度关系的叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| B.已知HF的酸性比CH3COOH强,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)] |
| C.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) |
| D.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
下述实验不能达到预期实验目的的是
| 序号 |
实验内容 |
实验目的 |
| A |
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 |
验证两者都发生了水解反应,且相互促进 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
下列溶液中,微粒的物质的量浓度关系一定正确的是( )
A.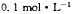 的硫化钾溶液中: 的硫化钾溶液中: |
B.常温下,pH=7的CH3COOH与CH3COONa的混合液中: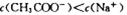 |
C.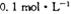 的NH4Cl溶液中: 的NH4Cl溶液中: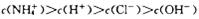 |
D.pH=3的一元酸和pH=11的一元强碱等体积混合: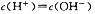 |
已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时,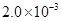 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: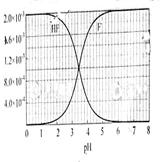
请根据以下信息回答下列问题:
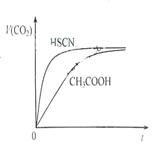
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka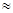 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与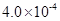 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显 (填“酸性”“中性”或“碱性”)。理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是 。A.c(A2-)+c(HA-)+c(H2A)="0.1" mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”、“>”或“=”),理由是 。
经测定某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且其浓度大小的排列顺序为:c (Na+)>c(CH3COO-)>c(OH-)>c(H+),下列有关说法正确的是
| A.该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的CH3COONa溶液等体积混合而成 |
| C.在上述溶液中加入适量CH3COOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) |
下列溶液中微粒浓度关系一定正确的是
| A.室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.室温时,pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列正确的叙述有
① CO2、NO2、P2O5均为酸性氧化物
② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦体积相同、pH相同的盐酸和醋酸溶液分别与锌粒反应,醋酸生成的氢气较多
⑧金属元素和非金属元素形成的化合物一定是离子化合物
| A.2个 | B.3个 | C.4个 | D.5个 |
下列溶液中微粒的物质的量浓度关系正确的是 ( )
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: |
2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
| A.④①②⑤⑥③ | B.④①②⑥⑤③ | C.①④②⑥③⑤ | D.①④②③⑥⑤ |
某酸性溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法正确的是
| A.溶液中离子浓度可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-) |
| B.该溶液不能由等物质的量浓度、等体积的盐酸和氨水混合而成 |
| C.可由pH=3的盐酸与pH=11的氨水等体积混合而成 |
| D.再通入适量氨气,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
I.如图1为向25mL 0.1mol·L—1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。请回答:
⑴ B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
| |
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
选用滴定管 |
| A |
碱 |
酸 |
酚酞 |
(乙) |
| B |
酸 |
碱 |
甲基橙 |
(甲) |
| C |
碱 |
酸 |
石蕊 |
(甲) |
| D |
酸 |
碱 |
酚酞 |
(乙) |
⑶ AB区间,c(OH—)>c(H+),则c(OH—)与c(CH3COO—)大小关系是________。
A.c(OH—)大于c(CH3COO—) B.c(OH—)小于c(CH3COO—)
C.c(OH—)等于c(CH3COO—) D.上述三种情况都可以
⑷在D点时,溶液中c(CH3COO—)+c(CH3COOH)________2c(Na+)(填“>”“<”或“=”)。
Ⅱ.t℃时,某稀硫酸溶液中c(H+) = 10—a mol·L—1,c(OH-) = 10—b mol·L—1,已知a+b=13:
⑸该温度下水的离子积常数Kw的数值为________。
⑹该温度下(t℃),将100mL 0.1mol·L—1的稀H2SO4与100mL 0.4mol·L—1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=________。
常温下,关于下列溶液的叙述错误的是
| A.CH3COOH分子可以存在于pH=8的碱性溶液中 |
| B.1mol/L氨水与0.5mol/L氨水中c(OH-)之比是2:1 |
| C.甲酸溶液和一定量NaOH溶液恰好完全反应,溶液中c(HCOO-)<c(Na+) |
| D.等体积等pH的醋酸和盐酸分别加水稀释至a mL和b mL,稀释后溶液pH均为5,则a>b |
下列说法正确的是( )
| A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④ |
| B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =" c" (S2―) +c (HS―)+c (OH―) |
D.AgCl悬浊液中存在平衡: AgCl(s) 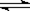 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
有一份铵盐混合物,取其质量为10.00g时,含有xmol的(NH4)2SO4和ymol的NH4HSO4 。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
测定结果如下;
铵盐混合物质量为10.00g和20.00g时,浓硫酸增加的质量相同;
铵盐混合物质量为30.00g时,浓硫酸增加的质量为0.68g;
铵盐混合物质量为40.00g时,浓硫酸的质量不变。
(1)A气体的化学式为______________
(2)10.00g铵盐混合物中含有NH4+的物质的量为_____mol(用含x,y的关系式表示),10.00g铵盐混合物溶于水后可电离出H+的物质的量为___mol(用含x,y的关系式表示)。
(3)在含有2 mol NH4+与1 mol H+的溶液中加入2 molOH—,加热充分反应,可产生气体A__________ mol
(4)计算:50.00mL的NaOH溶液的浓度为__________mol/L,该铵盐中氮元素的质量分数是 %;(计算结果均保留两位小数)
试题篮
()