下列溶液一定呈碱性的是
| A.溶液中c(OH-)>c(H+) | B.溶液中含有OH‑离子 |
| C.滴加甲基橙后溶液显红色 | D.滴加甲基橙后溶液显黄色 |
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);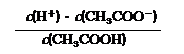
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L;已知:lg1.3=0.114);
⑷对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹常温时,有以下3种溶液,其中pH最小的是
⑺已知醋酸能 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
室温下,将pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液pH=11,则混合时强碱与强酸溶液的体积比是( )
| A.11∶1 | B.9∶1 | C.1∶11 | D.1∶9 |
有一种酸式盐AHB,它的水溶液呈弱碱性。今有下列几种说法,其中有错误的是( )
①相同的物质的量浓度的AOH溶液和H2B溶液,前者电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐在溶液中的电离方程式一般写成: AHB=A++HB- HB-=H++B2+
| A.①② | B.③④ | C.②③ | D.①④ |
(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则: B是____ __溶液(填溶质的化学式,下同),C是______,
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种可能:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(ⅰ)上述关系一定不正确的是__(填序号)。
(ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为__(填上列四种情况之一的序号);
(ⅲ)若四种离子浓度关系有c(NH4+)=" " c(Cl-),则该溶液一定显__(填“酸性”、“碱性”或“中性”)。
在恒温条件下,向CH3COONa稀溶液中分别加入少量下列物质:其中可使比值
c(CH3COO-)/c(Na+)增大的是
A. 固体NaOH B固体KOH.
C. 相同浓度的 CH3COONa稀溶液 D. 氯化钠固体
0.1 mol/L CH3COONa稀溶液中,下列离子浓度关系不正确的是
| A. c(Na+) + c(H+) = c(CH3COO-)+ c(OH-) |
| B. c(Na+) >c(CH3COO->c (OH-)>c(H+) |
| C. c(CH3COO- )+ c(CH3COOH)=" 0.1" mol/L |
| D. c(Na+)>c(CH3COO--)>c (H+)>c(OH-) |
向50 mL 1 mol/L AlCl3溶液中加入1 mol/L NaOH溶液a mL,充分反应后,生成的沉淀为0.02 mol,a有两个可能的数值,其中一个是180,另一个数值是
| A.40 | B.60 | C.80 | D.90 |
下列有关溶液pH的说法正确的是
| A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/L |
| B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11 |
| C.将pH=1的硫酸溶液和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3 |
| D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7 |
常温下,0.1 mol/L某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
下列各溶液中,各粒子的物质的量浓度关系正确的是
| A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-) |
| B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-) |
C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) +  c(HCO3-) + c(H+) c(HCO3-) + c(H+) |
| D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S) |
常温下有一PH为12的NaOH溶液100mL,如果将其PH将为11,那么
(1)若用蒸馏水应加入 mL (2)若用PH=10的NaOH溶液应加入 mL
(3)若用PH=2的盐酸应加入 mL (4)若用0.01mol/L的硫酸溶液应加入 mL
试题篮
()