(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol•L—1。
(2)浓度为0.1mol•L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3•H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ H+ +A2—。
H+ +A2—。
①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1•L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+) |
| B.c(Na+)> c(OH—)>c(HA—)> >c(A2—) > c(H+) |
| C.c(Na+)> c(H+)> c(A2—)> c(OH—)>c(HA—) |
| D.c(A2—)>c(Na+)> c(OH—) > c(H+)>c(HA—) |
(4)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.l×10—15、1.5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
下列说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| D.在Na2S稀溶液中,c(H+)-c(OH-) = c(HS-) +2 c(S2-)-c(Na+) |
(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 |
NH3·H2O |
HCl |
混合溶液的pH值 |
| 甲 |
c(NH3·H2O)=0.1mol·L-1 |
c(HCl)=0.1mol·L-1 |
pH=a |
| 乙 |
NH3·H2O的pH=12 |
HCl的pH=2 |
pH=b |
| 丙 |
c(NH3·H2O)="A" mol·L-1 |
c(HCl)=0.1mol·L-1 |
pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。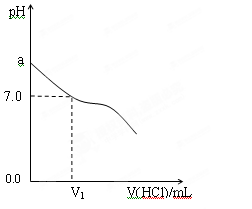
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
对常温下0.1mo1/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的c(H+)=1.0×10—13mo1/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO—)>c(OH—) |
| C.与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1mo1/L |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.其溶液的pH=13 |
| B.加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C.与AlCl3溶液反应的离子方程式为 Al3++3OH―=Al(OH)3↓ |
| D.滴加0.10 mol·L-1HNO3溶液到pH=7,溶液中离子浓度关系为:c (NO3―) = c(NH4+)> c(H+)=c(OH―) |
下列说法中,正确的是
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大 |
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
| 电解质 |
电离方程式 |
电离常数K |
Ksp |
| H2CO3 |
H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
- |
| C6H5OH |
C6H5OH C6H5O-+H+ C6H5O-+H+ |
1.1×10-10 |
- |
| H3PO4 |
H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
| NH3·H2O |
NH3·H2O OH-+NH4+ OH-+NH4+ |
1.76×10-5 |
- |
| BaSO4 |
BaSO4(s) Ba2++SO42- Ba2++SO42- |
- |
1.07×10-10 |
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是
A.c(HA)+c(A-)=c(Na+)=0.1 mol·L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时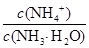 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
下列说法正确的是
| A.电解质溶液能导电,是因为在通电时电解质电离产生了自由移动的离子 |
| B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| C.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 |
| D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系: |
c(CH3COONa)> c(Na2CO3)> c(C6H5ONa)>c(NaOH)
下列叙述或表示正确的是( )
| A.常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B.氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2+ + HCO3—+OH— = CaCO3 ↓+ H2O |
| C.Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关。 |
| D.c(H+)=1×10-2 mol·L的溶液:Fe2+、Ba2+、N03-、Cl-不能大量共存。 |
有4种混合溶液,分别由等体积0.1 mol·L﹣1的两种溶液混合而成,①NH4Cl与CH3COONa
②NH4Cl与HCl③NH4Cl与NaCl④NH4Cl与NH3·H2O(混合液呈碱性)。下列各项排序正确的是( )
| A.pH:②<①<③<④ |
| B.c(NH4+):①<③<②<④ |
| C.溶液中c(H+):①<③<②<④ |
| D.c(NH3·H2O):①<③<④<② |
下列溶液中有关物质的量浓度关系正确的是
A.将0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c (NaOH)<c(CH3COONa)<c (NaHCO3)<c (C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c (Na+)>c (CH3COO-)>c(OH-)>c (H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c (CH3COOH)/c (CH3COO-)都将要变小
试题篮
()