环境污染已成为人类社会面临的重大威胁,下列对应关系错误的是:
| |
环境问题 |
造成环境问题的主要物质 |
| A |
酸雨 |
二氧化硫 |
| B |
白色污染 |
二氧化硅 |
| C |
温室效应 |
二氧化碳 |
| D |
臭氧层空洞 |
氟氯烃 |
工、农业及城市生活污水中含磷。家用洗涤剂是污水中磷的一个重要来源(洗涤剂中含有磷酸钠)。关于处理污水时要不要除去磷的说法正确的是:
| A.磷是生物所需的营养元素,不必除去 |
| B.含磷的污水是很好的肥料,不必除去 |
| C.含磷污水排到自然水中引起藻类增殖,使水变质,必须除去 |
| D.磷对人无毒,除去与否都无关紧要 |
“绿色奥运”是北京2008奥运会的三大主题之一,使用清洁能源,防治交通污染,改善空气质量,加速建设污水处理和回收工程,防止固体废弃物污染,植树造林,促进生态良性循环等,是北京实现“绿色奥运”主要工作。北京申奥时向国际奥委会承诺:位于北京城西的首都钢铁公司在2008年前迁出。
(1)首钢为什么会对北京市区环境造成污染?
(2)其主要的大气污染物各是怎样形成的(写出必要的化学方程式)?
(3)请用化学方程式表示其中任意一种污染物对北京造成的危害。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:

①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:

①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。

(6)氧化—还原法消除NOx的转化如下:

①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
用热的纯碱溶液洗去油污 |
Na2CO3可直接和油污反应 |
| B |
漂白粉在空气中久置变质 |
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C |
用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 |
酸性高锰酸钾溶液能还原水果释放的催熟剂乙烯 |
| D |
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 |
K2CO3与NH4Cl反应生成氨气会降低肥效 |
分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、SO2、NOx等,其主要来源为燃煤和机动车尾气排放等。
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
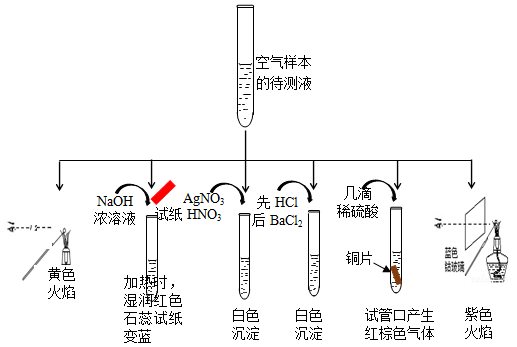
① 该实验能确认存在的阳离子是 。
② 该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③ 根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)燃煤厂为减少SO2的排放,可采取的措施是:
① 洗涤含SO2的烟气,下列物质可作洗涤剂的是______。
a.浓NH3∙H2O b.NaHCO3 c.FeCl3 d.NaHSO3
② 将煤转化为清洁气体燃料,过程如图所示:
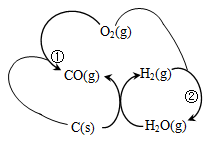
已知:反应①生成1molCO(g)的反应热△H= -110.5KJ/mol反应②生成1molH2O(g)的反应热△H= -241.6KJ/mol焦炭与水蒸气反应的热化学方程式是________________。
(3) 汽车尾气处理系统可将CO和NO转化成无毒物质,其化学反应方程式是________________
(4)为将CO和NO转化为无毒物质,某同学设计了如图装置。

①电极a是________极;
②甲的化学式是 ;
③电极b的电极反应式是____________。
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点。当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇。其流程如下:

①上述流程中碳酸钾溶液所起的作用是 。
②在分解池中发生的反应为 (写出化学方程式)。
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业, 可用作气体吸附剂,干粉灭火剂,橡胶防老剂等。
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-=HCO3- HCO3-+OH-=CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑
①小王同学在实验室用如图所示的装置和药品制取K2CO3溶液。

他所制得的溶液中可能含有的杂质是 。
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50 ml硫酸,测得如下数据:
实验编号 1 2 3
混合物的质量/g 3.76 4.70 8.46
硫酸溶液的体积/mL 50.00 50.00 50.00
生成二氧化碳的物质的量/mol 0.03 0.0375 0.03
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是 所用硫酸的物质的量浓度为 mol•L-1。
保护环境、保护地球已成为人类共同的呼声。
(1)酸雨的pH小于5.6,下列气体排放可能会形成酸雨的是( )
A、N2 B、CO C、SO2 D、氟氯代烷
(2)下列措施不利于环境保护的是( )
A、推广使用无铅汽油 B、提倡使用太阳能
C、推广使用无磷洗衣粉 D、提倡个人使用大批量汽车
(3)垃圾是放错了位置的资源。如废弃的热塑性塑料可通过清洗、熔融,重新制成塑料。塑料属于( )
A、无机非金属材料 B、有机合成材料
C、复合材料 D、合金
(4)钢铁腐蚀给人类带来巨大损失,海边铁制品较易被腐蚀的原因是___________________。
水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、:Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有 、 和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于 中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比, 洗涤效果较好,原因是 。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因: 。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是 。
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是
| A.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 |
| C.铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 |
| D.DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 |
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源.治理方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体.
(1)写出CO与NO反应的化学方程式______________.
(2)控制城市空气污染源的方法可以有__________.
a.开发氢能源 b.使用电动车
c.植树造林 d.戴上呼吸面具
(3)“催化剂转换器”的缺点是在一定程度上提高空气的酸度,其原因是_______________________。
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点。可以通过氧化还原反应或酸碱反应进行脱硫和脱硝。完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染。
写出CH4与NOx反应的化学方程式 。
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO (g)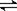 N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。
N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。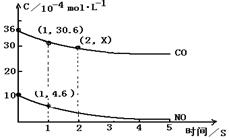
前1s内平均反应速率v(N2)
第2s时的X值范围 。
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏。而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气。
说明理由:
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量。写出此测定方法的离子方程式 。
(5)双碱法是一种低成本高效率的脱硫方法。先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用。
可用作第一碱 。可用作第二碱 。(选填编号)
a.NaOH b.Mg(OH)2 c.石灰石 d.石灰
工业上采用下列工艺流程将石油废气中的硫化氢转化为硫酸和氢气等产品以防止污染。
(1)反应器1中装有硫酸铁的酸性溶液。
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因 。
②反应器1中发生反应的离子方程式是______.
(2)反应器3中发生反应的化学方程式是 。
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是______.
(4)电解滤液1的工作原理示意图如下:
①乙电极是 (填“阴”或“阳”)极。
②甲电极的电极反应式是 。
③电解滤液1的离子方程式是 。
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是_____。(填字母)
a.苯 b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风
b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料
d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是 。
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对____产生破坏作用而被禁止、限制使用。
(5)“汽车尾气污染”已倍受世人关注。以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为 (保留三位小数)。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: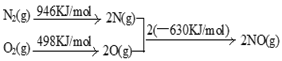
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: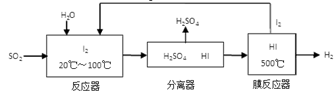
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
试题篮
()