随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是_____。(填字母)
a.苯 b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风
b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料
d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是 。
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对____产生破坏作用而被禁止、限制使用。
(5)“汽车尾气污染”已倍受世人关注。以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为 (保留三位小数)。
【化学——选修2:化学与技术】
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式___________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是____________________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。
数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、:Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有 、 和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于 中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比, 洗涤效果较好,原因是 。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因: 。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是 。
工业上采用下列工艺流程将石油废气中的硫化氢转化为硫酸和氢气等产品以防止污染。
(1)反应器1中装有硫酸铁的酸性溶液。
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因 。
②反应器1中发生反应的离子方程式是______.
(2)反应器3中发生反应的化学方程式是 。
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是______.
(4)电解滤液1的工作原理示意图如下:
①乙电极是 (填“阴”或“阳”)极。
②甲电极的电极反应式是 。
③电解滤液1的离子方程式是 。
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用 药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是 ,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是 。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是 ,植物油在体内水解最终产物是高级脂肪酸和 。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为 。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成 (填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为 。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是 (任答一点)。
②碳化硅硬度很大,它属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 ;
保护环境、保护地球已成为人类共同的呼声。
(1)酸雨的pH小于5.6,下列气体排放可能会形成酸雨的是( )
A、N2 B、CO C、SO2 D、氟氯代烷
(2)下列措施不利于环境保护的是( )
A、推广使用无铅汽油 B、提倡使用太阳能
C、推广使用无磷洗衣粉 D、提倡个人使用大批量汽车
(3)垃圾是放错了位置的资源。如废弃的热塑性塑料可通过清洗、熔融,重新制成塑料。塑料属于( )
A、无机非金属材料 B、有机合成材料
C、复合材料 D、合金
(4)钢铁腐蚀给人类带来巨大损失,海边铁制品较易被腐蚀的原因是___________________。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: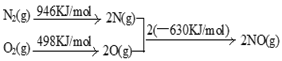
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: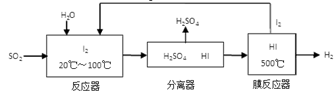
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、SO2、NOx等,其主要来源为燃煤和机动车尾气排放等。
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
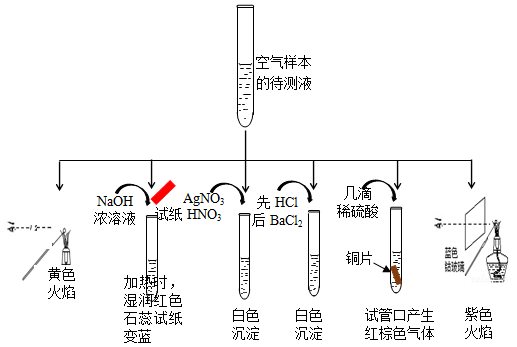
① 该实验能确认存在的阳离子是 。
② 该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③ 根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)燃煤厂为减少SO2的排放,可采取的措施是:
① 洗涤含SO2的烟气,下列物质可作洗涤剂的是______。
a.浓NH3∙H2O b.NaHCO3 c.FeCl3 d.NaHSO3
② 将煤转化为清洁气体燃料,过程如图所示:
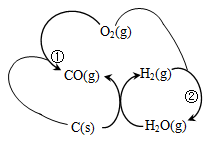
已知:反应①生成1molCO(g)的反应热△H= -110.5KJ/mol反应②生成1molH2O(g)的反应热△H= -241.6KJ/mol焦炭与水蒸气反应的热化学方程式是________________。
(3) 汽车尾气处理系统可将CO和NO转化成无毒物质,其化学反应方程式是________________
(4)为将CO和NO转化为无毒物质,某同学设计了如图装置。

①电极a是________极;
②甲的化学式是 ;
③电极b的电极反应式是____________。
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH =_____________ 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
③检验产物中含有硫酸的方法是___________________。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源.治理方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体.
(1)写出CO与NO反应的化学方程式______________.
(2)控制城市空气污染源的方法可以有__________.
a.开发氢能源 b.使用电动车
c.植树造林 d.戴上呼吸面具
(3)“催化剂转换器”的缺点是在一定程度上提高空气的酸度,其原因是_______________________。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:

①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:

①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。

(6)氧化—还原法消除NOx的转化如下:

①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1:1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是 。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
| 项目 |
监测结果 |
国标号 |
|
| 处理前 |
处理后 |
GWKB3—2000 |
|
| 烟尘(mg/m3) |
13929.0 |
61.0 |
80 |
其获得监测结果中的数据使用的测定方法为 。
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点。当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇。其流程如下:

①上述流程中碳酸钾溶液所起的作用是 。
②在分解池中发生的反应为 (写出化学方程式)。
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业, 可用作气体吸附剂,干粉灭火剂,橡胶防老剂等。
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-=HCO3- HCO3-+OH-=CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑
①小王同学在实验室用如图所示的装置和药品制取K2CO3溶液。

他所制得的溶液中可能含有的杂质是 。
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50 ml硫酸,测得如下数据:
实验编号 1 2 3
混合物的质量/g 3.76 4.70 8.46
硫酸溶液的体积/mL 50.00 50.00 50.00
生成二氧化碳的物质的量/mol 0.03 0.0375 0.03
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是 所用硫酸的物质的量浓度为 mol•L-1。
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点。可以通过氧化还原反应或酸碱反应进行脱硫和脱硝。完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染。
写出CH4与NOx反应的化学方程式 。
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO (g)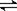 N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。
N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。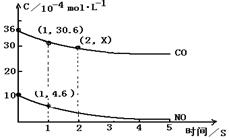
前1s内平均反应速率v(N2)
第2s时的X值范围 。
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏。而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气。
说明理由:
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量。写出此测定方法的离子方程式 。
(5)双碱法是一种低成本高效率的脱硫方法。先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用。
可用作第一碱 。可用作第二碱 。(选填编号)
a.NaOH b.Mg(OH)2 c.石灰石 d.石灰
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
试题篮
()