二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:

碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 |
Ca(OH)2 |
NaOH |
| 价格(元/kg) |
0.36 |
2.9 |
| 吸收SO2的成本(元/mol) |
0.027 |
0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、SO2、NOx等,其主要来源为燃煤和机动车尾气排放等。
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
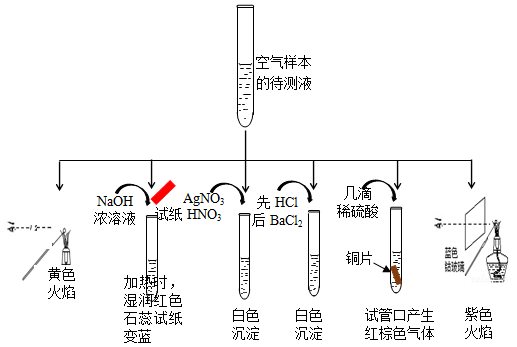
① 该实验能确认存在的阳离子是 。
② 该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③ 根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)燃煤厂为减少SO2的排放,可采取的措施是:
① 洗涤含SO2的烟气,下列物质可作洗涤剂的是______。
a.浓NH3∙H2O b.NaHCO3 c.FeCl3 d.NaHSO3
② 将煤转化为清洁气体燃料,过程如图所示:
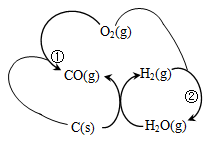
已知:反应①生成1molCO(g)的反应热△H= -110.5KJ/mol反应②生成1molH2O(g)的反应热△H= -241.6KJ/mol焦炭与水蒸气反应的热化学方程式是________________。
(3) 汽车尾气处理系统可将CO和NO转化成无毒物质,其化学反应方程式是________________
(4)为将CO和NO转化为无毒物质,某同学设计了如图装置。

①电极a是________极;
②甲的化学式是 ;
③电极b的电极反应式是____________。
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH =_____________ 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
③检验产物中含有硫酸的方法是___________________。
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(2)下图是某市污水处理的工艺流程示意图:
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
当今水体的污染成为人们关注的焦点。利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol·L-1时,溶液中c(PO43-)= mol·L-1。
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ;与方法一相比,方法二的优点为 。
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为 。
(3)工业上也会利用铝粉除去含氮废水中的NO3-。现在处理100m3浓度为2.0×10-4 mol·L-1的NaNO3溶液,加入一定量的2 mol·L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4∶1,求此过程中消耗铝的质量。(写出计算过程,无过程以0分计算)
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: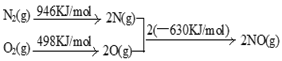
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: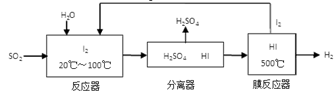
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),该尾气的处理方法是 _。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用 药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是 ,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是 。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是 ,植物油在体内水解最终产物是高级脂肪酸和 。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为 。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成 (填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为 。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是 (任答一点)。
②碳化硅硬度很大,它属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 ;
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1:1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是 。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
| 项目 |
监测结果 |
国标号 |
|
| 处理前 |
处理后 |
GWKB3—2000 |
|
| 烟尘(mg/m3) |
13929.0 |
61.0 |
80 |
其获得监测结果中的数据使用的测定方法为 。
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点。当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇。其流程如下:

①上述流程中碳酸钾溶液所起的作用是 。
②在分解池中发生的反应为 (写出化学方程式)。
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业, 可用作气体吸附剂,干粉灭火剂,橡胶防老剂等。
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-=HCO3- HCO3-+OH-=CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑
①小王同学在实验室用如图所示的装置和药品制取K2CO3溶液。

他所制得的溶液中可能含有的杂质是 。
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50 ml硫酸,测得如下数据:
实验编号 1 2 3
混合物的质量/g 3.76 4.70 8.46
硫酸溶液的体积/mL 50.00 50.00 50.00
生成二氧化碳的物质的量/mol 0.03 0.0375 0.03
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是 所用硫酸的物质的量浓度为 mol•L-1。
(1)(3分)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是 (填字母)。
a.CO2 b.N2 c.NO2
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有 (填字母)标志的垃圾筒内。
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是 (填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(2)酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因。


(3)汽车尾气中一氧化氮与一氧化碳催化转化的 化学方程式为 。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是 ,ClO2的作用是 。
化学方程式为 。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是 ,ClO2的作用是 。
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、:Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有 、 和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于 中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比, 洗涤效果较好,原因是 。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因: 。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是 。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:

①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:

①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。

(6)氧化—还原法消除NOx的转化如下:

①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
(1)造成水体污染的原因是 。(填序号)
① 生活污水的任意排放 ② 工业废水的任意排放
(2)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:
_____ 。
(3)有机合成材料的出现是材料发展史上的一次重大突破。人们常说的三大合成
材料是指 、 和 。
试题篮
()