向体积为10 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡Ⅰ,此时测得容器内的压强为起始时的1.2倍,则且Y表示的反应速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内反应速率分别为:甲: 丙:
丙: 。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向Ⅰ的平衡体系中充入氮气,则平衡 (填“向左”或“向右”或“不”)移动;若将Ⅰ的平衡体系中部分混合气体移走,则平衡 (填“向左”或“向右”或“不”)移动;
(4)若在相同条件下向Ⅰ的平衡体系中再充入0.5 mol X气体,则原平衡Ⅰ中X的转化率与重新平衡后X的转化率相比较 (选填字母)。
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时各气体体积分数与Ⅰ平衡相同,且起始时维持化学反应向逆反应方向进行。则c的取值范围应该为 。
一定条件下,在某密闭容器中,有下列可逆反应:
2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中
2Z(g);△H<0,下列有关该反应的说法中 正确的是 ( )
正确的是 ( )
| A.该反应的正反应为吸热反应 |
| B.当各物质浓度不再变化时,反应达到平衡状态 |
| C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动 |
| D.若升高温度,平衡向正反应的方向移动 |
恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 + O2 2SO3,下列不能用来
2SO3,下列不能用来 判断该反应达到平衡状态的是
判断该反应达到平衡状态的是

A.容器中压强不再变化 |
B.SO2的体积分数不再变化 |
C.容器中各物质的浓度不再变化 |
D.单位时间内生成SO2的物质的量与消耗SO3的物质的量相等 |
工业上利用反应:CO(g)+H2O(g) CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。

若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系
如下表:
| t/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c4 |
| 4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
| A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中H2(g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的消耗速率 |
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”)。
(4)达平衡时CO2的反应速率 ,CO(g)的转化率为 。
一氧化碳与水蒸气的反应为CO(g) + H2O(g) 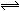 CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9
CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9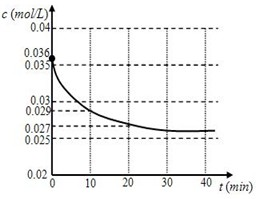
(1)跟踪测定H2O的物质的量浓度,如图所示,则0 —20 min ,H2O的反应速率是
(2)请在图中用实线绘制出在该温度下加入正催化剂后,H2O的物质的量浓度变化图线。
(3)从434℃升温至800℃,800℃的平衡常数K2 =1,则正反应为_____________(填“放
热反应”或“吸热反应”或“不能确定”)。
(4)求在800℃反应达平衡时,CO转化为CO2的转化率(写出必要的计算过程)
25℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1= 1.3×10-7 K2= 7.1×10-15 |
25℃时,下列说法正确的是
| A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b |
| C. NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)="=" c(OH-)+ c(HS-)+2c(S2-) |
| D.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L |
(3分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: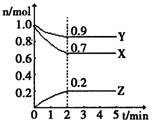
(1)该反应在______min时达到化学平衡状态。
(2)该反应的化学方程式是_______________________________。
(3)从开始到2 min ,Z的平均反应速率是_________________________。
一定条件下,在体积不变的密闭容器中,能表示反应 一定达到化学平衡状态的是
一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1:2:2 ②X的浓度不再变化
③容器中的压强不再变化 ④Z的物质的量不再变化
⑤气体的密度不再改变
| A.①②③ | B.②③④ | C.②④⑤ | D.①③⑤ |
某固定容积的2L密闭容器中进行反应 : 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
: 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
(1)这5分钟内用N2来表示该反应的反应速率(请写出计算过程,下同)
(2)求平衡时H2的物质的量浓度
(3)平衡时容器的压强为初始时的几分之几?
一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是:
| A.达到化学反应平衡时,生成的NH3为2mol |
| B.达到化学反应平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学反应平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学反应平衡时,正反应和逆反应的速率都为零 |
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3 _________ mol;
(2)O2的转化率为_____________;
(3)平衡时体系中SO2的百分含量(体积分数)为 __________;
(4)降低温度,O2的转化率____________;v正____________;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量__________。(填“增大”、“减小”或“不变”)
在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g)  2B(g)+C(g)。该反应达到平衡的标志是( )
2B(g)+C(g)。该反应达到平衡的标志是( )
A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化
(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;
若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)若平衡时两容器中的压强不相等,则两容器中压强之比为 。
(3)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。
在容积相同的甲、乙两个密闭容器中,均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
| A.反应过程中的某时刻,甲容器中的反应速率比乙中的大 |
| B.达到平衡时,甲容器反应所需时间比乙容器少 |
| C.乙容器中SO2的转化率大于25% |
| D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2 |
试题篮
()