 X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
| A.增加少量W,正反应速率减小 | B.当容器中气体的密度不变时,反应达到平衡 |
| C.降低温度 ,平衡不移动 | D.平衡后加入Z ,则W的质量增大 |
| A.O2的消耗速率等于NO的消耗速率 |
| B.容器中存在N2,O2,NO三种气体 |
| C.容器内混合物总的物质的量不随时间而改变 |
| D.单位时间内每生成n mol N2的同时生成2n mol NO |
达到平衡后,下列说法中一定正确的是
| A.平衡时,用A的浓度变化表示的正反应速率是用B的浓度变化表示的逆反应速率的a/b倍 |
| B.保持容器内气体压强不变,再通入稀有气体,平衡不移动 |
| C.保持容器体积不变,再通入一定量的C,建立新的平衡状态时,A的体积分数与原平衡时相同 |
| D.保持容器体积不变,增加B的物质的量,建立新的平衡状态时,A的转化率升高 |


| A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B.达到平衡后,隔板K最终停留在左侧刻度0~2之间 |
| C.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |

| A.由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图象Ⅱ知,该反应在t5阶段NH3体积分数最大 |
| C.图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
| D.由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L |


(1)请在图中画出c(H2)随时间t的变化曲线图;
(2)平衡时c(O2)平为 mol/L。
(3)欲计算出平衡时O2的浓度,除已知“H2O(g)
和CO”的物质的量外,至少需要知道平衡体
系中某两种气体的平衡浓度。这两种气体除
可以是H2O和CO2外还可以是 。
(4)在其它条件不变的情况下,若改为起始时在
容器中充入2molH2和2molCO2,则上述两反
应达到平衡时,c(O2)平= mol/L。
某化学科研小组研究在其他条件不变时,改变某一条
件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,
2AB3(g)化学平衡状态的影响,
得到如下图所示的变化规律(图中T表示温度,n表
示物质的量),根据如图可得出的判断结论正确的是
( )
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3
将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:
|
 2A(g) + 2B(g) 3C(g) ; △H<0.下列说法不正确的是
2A(g) + 2B(g) 3C(g) ; △H<0.下列说法不正确的是 ( )
( )




恒温下,将16 mol N2与24 mol H2的混合气体通入一个固定容积为4L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),10分钟后反应达平衡时,NH3的含量(体积分数)为25%,下列的关说法正确的是 ( )
2NH3(g),10分钟后反应达平衡时,NH3的含量(体积分数)为25%,下列的关说法正确的是 ( )
| A.达到平衡时,N2和H2的转化率之比为1:1 |
| B.10分钟内v(H2)=0.35mol/(L·min) |
| C.平衡混合气体的密度为128g/L |
| D.平衡混合气体中,n(N2):n(H2):n(NH3)=1:3:2 |
氮化硅(Si3N4)是一种新型陶瓷材料,它可通过以下反应制得:
3SiO2+ 6C + 2N2  Si3N4 + 6CO,有关说法不正确的是 ( )
Si3N4 + 6CO,有关说法不正确的是 ( )
A.该反应的平衡常数表达式为 |
| B.若增大压强,则上述平衡向逆反应方向移动 |
| C.该反应中只有N2是氧化剂 |
| D.该反应在高温下反应,△H一定大于零 |
Ⅰ. 加入3mol SO2和2mol O2发生反应,达到平衡时放出的热量为 ____________
Ⅱ. 保持同一反应温度,在相同容器中,将起始物质的量改为 a mol SO2 、 b mol O2 、c mol SO3 (g) ,欲使平衡时SO3的体积分数为2/9。
⑴达到平衡时,Ⅰ和Ⅱ放出的热量 ______(填序号)
A.—定相等 B.前者一定小 C. 前者大于或等于后者
(2) a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)________________
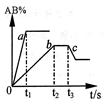
| A.A2 、B2 、AB 均为气体,正反应放热 |
| B.AB 为气体,A2 、B2中最少有一种为非气体,正反应放热 |
| C. AB 为气体,A2 、B2中:最少有一种为非气体,正反应吸热 |
| D.AB 为固体,A2 、B2中最少有一种为气体,正反应吸热 |
在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
 |
下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能增大了反应体系的压强
在温度恒定时,在1L密闭容器中存在着H2、I2、HI三种物质,下列图象均是表示此反应的有关量值与时间或外界条件时关系的,下列有关叙述错误的是 ( )
| A.图①中,t0时三种物质的物质的量相等 |
| B.图②中逆反应为H2+I2→2HI |
| C.图③中t2改变条件后容积内各成分百分含量均会发生变化 |
| D.图④表明HI起始数量的不同,不会改变平衡体系的各成份百分含量 |
| 物质 |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
| 沸点/℃ |
1465 |
1412 |
181(升华) |
57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
试题篮
()