向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2 2NO+O2。达到平衡状态的标志是①体系的颜色不再发生变化 ②容器内压强不随时间变化而变化 ③NO和O2的消耗速率之比为2:1 ④容器中c(NO2):c(NO):c(O2)=2:2:1
2NO+O2。达到平衡状态的标志是①体系的颜色不再发生变化 ②容器内压强不随时间变化而变化 ③NO和O2的消耗速率之比为2:1 ④容器中c(NO2):c(NO):c(O2)=2:2:1
| A.①② | B.③④ | C.①④ | D.②③ |
在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
| A.X生成的速率与Z分解的速率相等 |
| B.单位时间生成a mol X,同时生成3a mol Y |
| C.X、Y、Z的分子数比为1∶3∶2 |
| D.X、Y、Z的浓度不再变化 |
下图是温度和压强对X+Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种是气态,Z为气态 |
| D.上述反应的逆反应的△H>0 |
在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减少了 | D.a>b |
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应2R(气)+5Q(气) 4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
(10分)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: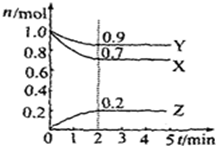
(1)该反应的化学方程式为__ ____.
(2)反应开始至2min,用X表示的平均反应速率为______ mol·L-1·min-1;
平衡时,Y的转化率为__ ____,
平衡时,Z的浓度为___ ___ mol·L-1。
(3)下列叙述能说明上述反应达到平衡状态的是_____ _(填选项、多选)
| A.X、Y、Z的物质的量之比为3:1:2 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.混合气体的总物质的量不随时间的变化而变化.
下列叙述中可以说明反应2HI(g)  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分组成HI%=I2%
④反应速率v(H2)=v(I2)=1/2v(HI)
⑤[HI]∶[H2]∶[I2]=2∶1∶1
⑥v(HI)分解=v(HI)生成
⑦压强不变
| A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
可逆反应2NO+O2 2NO2二氧化氮红棕色在密闭容器中反应,达到平衡状态的标志是
2NO2二氧化氮红棕色在密闭容器中反应,达到平衡状态的标志是
| A.NO2、NO和O2 三者共存 |
| B.单位时间内生成n molO2的同时生成2n mol NO |
| C.容器中颜色不再变化 |
| D.容器中NO2、NO、O2的物质的量浓度之比为2:2:1的状态 |
在密闭容器中进行X2(g)+Y2(g) 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1mol∙L-1、0.3mol∙L-1、0.2mol∙L-1,反应达到平衡时,各物质浓度可能是
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1mol∙L-1、0.3mol∙L-1、0.2mol∙L-1,反应达到平衡时,各物质浓度可能是
| A.c(X)=0.2mol∙L-1 | B.c(Y2)=0.35mol∙L-1 |
| C.c(Y2)=0.2mol∙L-1 | D.c(Z)=0.4mol∙L-1 |
将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:
2SO2(g)+ O2(g)  2SO3(g)
2SO3(g)
下列哪些情况能说明化学反应已达反应限度的是
| A.混合气体的压强不再变化 |
| B.混合气体的总质量不再变化 |
| C.每生成2mol SO3的同时,消耗1mol SO2 |
| D.每生成2mol SO2的同时,消耗2mol SO3 |
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)若升高温度,甲醇的生成率减小,则该反应的正反应为__________反应(放热或吸热);
(2)改变下列条件,不能加快化学反应速率的是__________;
a.移走甲醇 b.增大压强
c.扩大容器体积 d.升高温度
(3)写出两个既能加快反应速率,又能使一氧化碳的转化率提高的措施:_______________;______________________________________。
下图曲线a表示放热反应X(g)+Y(g)  Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.加催化剂 |
| B.升高温度 |
| C.增大体积 |
| D.加大X的投入量 |
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示2min内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大
相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是
H2(g)+I2(g),达到平衡状态的标志是
| A.c(H2)保持不变 |
| B.拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
| C.HI、H2、I2的浓度比为2:1:1 |
| D.正反应和逆反应都已停止 |
试题篮
()