下列事实能用勒夏特列原理解释的是( )
A.FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D.对于反应2NO2(g) N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深
在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g) N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
A.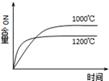 4NH3(g)+5O2(g) 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=﹣a kJ•mol﹣1 4NO(g)+6H2O(g)△H=﹣a kJ•mol﹣1 |
B.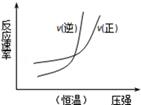 N2(g)+3H2(g) N2(g)+3H2(g) 2NH3(g)△H=﹣b kJ•mol﹣1 2NH3(g)△H=﹣b kJ•mol﹣1 |
C.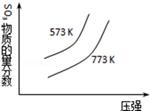 2SO3(g) 2SO3(g) 2SO2(g)+O2(g)△H="+c" kJ•mol﹣1 2SO2(g)+O2(g)△H="+c" kJ•mol﹣1 |
D.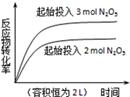 2N2O5(g) 2N2O5(g) 4NO2(g)+O2(g)△H="+d" kJ•mol﹣1 4NO2(g)+O2(g)△H="+d" kJ•mol﹣1 |
下列说法正确的是( )
| A.已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定 |
| B.测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高, 说明碳的非金属性强于硅。 |
C.温度和压强一定时,对于可逆反应:2NO2(g) N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 |
| D.将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
下列有关说法正确的是( )
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
B.反应A(g) 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS <0 |
在恒容密闭容器中加入一定量的X并发生反应:2X(g) Y(g),在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

| A.该反应进行到N点放出的热量大于进行到W点放出的热量 |
B.T2下,在0 ~t1时间内,c(Y)= mol·L-1·min-1 mol·L-1·min-1 |
| C.W点的正反应速率V正大于N点的逆反应速率V逆 |
| D.W点时再加入一定量X,再达平衡后X的转化率减小 |
恒温恒容条件下,可逆反应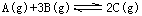 达到平衡,下列叙述不是反应达到平衡的标志
达到平衡,下列叙述不是反应达到平衡的标志
① C的生成速率与C的分解速率相等
② 单位时间生成amolA,同时生成3amolB
③ A、B、C的浓度均不再变化
④ A、B、C的物质的量之和不再变化
⑤ 混合气体的总压强不再变化
⑥ 混合气体的密度不再变化
⑦ 单位时间内消耗a molA,同时生成3a molB
⑧ A、B、C的物质的量之比为1︰3︰2
A.⑤⑥⑧ B.③④⑦ C.①③⑥ D.②⑥⑧
反应SO2(g) + NO2(g)  NO(g) + SO3(g)在一定条件下建立平衡,保持温度和容器体积不变再加入一定量的O2,下列说法正确的是
NO(g) + SO3(g)在一定条件下建立平衡,保持温度和容器体积不变再加入一定量的O2,下列说法正确的是
| A.平衡左移,容器内压强不一定增大 |
| B.平衡右移,达到平衡时容器内压强一定增大 |
| C.平衡右移,SO2的转化率提高 |
| D.平衡不一定移动,容器内压强一定增大 |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:
X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
在密闭容器中发生如下反应:aX(g)+bY(g)  cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a+b<c+d |
| C.Z的体积分数增加 | D.X的转化率下降 |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.平衡移动,K值一定变化 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.K值不变,平衡可能移动 |
可逆反应2NO2(g) N2O4(g) △H<0,在密闭容器中进行并达到平衡,欲通过改变条件达到新平衡后使混合气体颜色加深,可采取的措施是
N2O4(g) △H<0,在密闭容器中进行并达到平衡,欲通过改变条件达到新平衡后使混合气体颜色加深,可采取的措施是
| A.增大容器体积 |
| B.保持温度压强不变,充入N2O4(g) |
| C.保持温度压强不变,充入NO2(g) |
| D.保持容器容积不变,升高温度 |
已知:2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol
某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/(mol·L-1) |
0.8 |
1.24 |
1.24 |
下列说法正确的是
A.平衡后升高温度,平衡常数>400
B.平衡时,反应混合物的总能量增加20 kJ
C.平衡时,c(CH3OCH3)=1.6 mol/L
D.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
试题篮
()